题目内容
【题目】请根据下列各图中有关信息,回答下列问题:
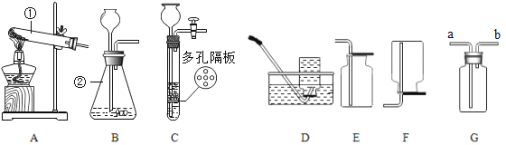
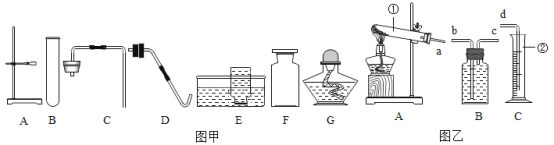
(1)写出仪器的名称:①___________,②___________。
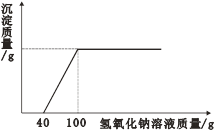
(2)若用装置B制取氧气时,反应的文字表达式为_______________,属于______(填“分解”或“化合”)反应;实验时,长颈漏斗下端要伸入液面以下,其原因是_____________。若要收集到较纯净的氧气,其收集装置应选_____(填字母)。
(3)实验制取二氧化碳选择的药品有_________和__________,反应的文字表达式是___________,实验室常用装置C制取二氧化碳,与装置B相比,其优点是_______________。若用G装置收集二氧化碳气体,气体应从_______端(填“a”或“b”)进入,其验满的方法是_________________。
(4)已知:氨气是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水,实验时常用氯化铵和熟石灰的固体混合物来制备氨气,请你从图中选择制备一瓶氨气所需要的装置组合为__________(填字母)。
【答案】试管 锥形瓶 过氧化氢![]() 水+氧气 分解 防止气体从长颈漏斗逸出 D 石灰石或大理石 稀盐酸 碳酸钙+盐酸→氯化钙+水+二氧化碳 可以控制反应的发生和停止 a 将燃着的木条伸到导管b处,木条熄灭,证明已集满 AF
水+氧气 分解 防止气体从长颈漏斗逸出 D 石灰石或大理石 稀盐酸 碳酸钙+盐酸→氯化钙+水+二氧化碳 可以控制反应的发生和停止 a 将燃着的木条伸到导管b处,木条熄灭,证明已集满 AF
【解析】
(1)据图可知仪器①是试管,②是锥形瓶;
(2)利用装置B制取氧气时不需要加热,应该是利用过氧化氢和二氧化锰制取,反应的文字表达式是:过氧化氢![]() 水+氧气,属于分解反应;实验时,锥形瓶内长颈漏斗下端要插入液面以下,其原因是防止气体从长颈漏斗逸出;若要收集到较纯净的氧气,应用排水法收集;
水+氧气,属于分解反应;实验时,锥形瓶内长颈漏斗下端要插入液面以下,其原因是防止气体从长颈漏斗逸出;若要收集到较纯净的氧气,应用排水法收集;
(3)在常温下用石灰石或大理石和稀盐酸来制取二氧化碳,因此不需要加热,反应的文字表达式是:碳酸钙+盐酸→氯化钙+水+二氧化碳;实验室用装置C制取二氧化碳,与装置B相比,其优点为可以控制反应的发生和停止;如用G装置收集CO2,由于二氧化碳的密度大于空气,所以应该用向上排空气法收集,则气体应从 a端通入;将燃着的木条伸到导管b处,木条熄灭,证明已集满;
(4)氯化铵与氢氧化钙在加热的条件下反应生成氯化钙、水和氨气;属于固体加热型,应该选用的发生装置是A;氨气密度比空气小,极易溶于水,可选用向下排空气法收集,即收集装置为F。

【题目】二氧化锰可作过氧化氢溶液分解的催化剂,兴趣小组想探究过氧化氢分解有没有其他催化剂,以及影响过氧化氢分解速率的因素除催化剂外还有哪些。
Ⅰ.(提出问题)氧化铁能否作过氧化氢分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
①分别取5mL5%过氧化氢溶液放入A、B两支试管中,向A中加入1g氧化铁粉末,并分别在A、B试管中插入带火星的木条,观察现象。 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象。 |
②待A中没有现象发生时,重新加入过氧化氢溶液,把带火星的木条伸入试管,如此反复3次。 | 试管中均产生气泡,带火星的木条均复燃。 |
③将步骤②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量为ag。 |
|
④分别取5mL5%过氧化氢溶液放入C、D两支试管中,向C中加入1g氧化铁粉末,向D中加入1g二氧化锰粉末,观察现象。 |
|
(实验结论)
(1)步骤②证明氧化铁的___在反应前后没有发生变化;③中如果a=___,证明氧化铁的___在反应前后没有发生变化。由①②③可知,氧化铁可以作过氧化氢分解的催化剂。
(2)写出试管A中发生反应的文字表达式___。
(实验评价)
设计实验步骤④的目的是___,若观察到D试管中产生气泡的速率比C试管中快,由此可以得到的结论是___。
Ⅱ.探究过氧化氢溶液浓度对过氧化氢分解速率的影响。
(交流讨论)可以通过测定相同条件下不同浓度过氧化氢溶液___来探究。
A 产生相同体积氧气的时间 B 产生氧气的总体积 C 单位时间内产生氧气的体积
(实验探究)
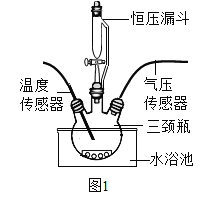
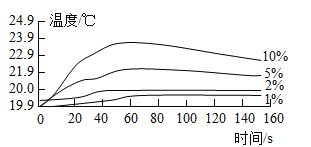
按图1装置进行实验:水浴温度控制在21℃,二氧化锰均为0.5g,过氧化氢溶液均为5mL,三颈瓶容积为250mL,恒压漏斗(漏斗的支管与三颈瓶相连)的作用是使过氧化氢溶液自行下滴。数字传感器数据绘制图像如图2、图3。

(实验结论)
图2说明过氧化氢溶液浓度与反应速率之间的关系是____,结合图3,以10%H2O2溶液为例分析,三颈瓶内气压后来慢慢降低的原因是_____。