题目内容
【题目】元素周期表是化学学习和研究的工具。下图是元素周期表的一部分。
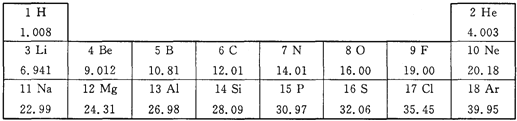
(1)从图中查出硅元素处于元素周期表中第__________主族;
(2)X2+与O2-的核外电子排布相同,则X的元素位于期表中第三周期,它与氧元素组成的化合物的名称__________。
(3)图中镁元素与氯元素最本质的区别是它们原子中__________不同;
(4)两种元素具有相似化学性质的组是__________;(填序号)
①Na、 Cl ② O、S ③ F、C1 ④Cl、 Ar
(5)若图表示的是某离子的结构示意图,则m=_______________。
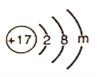
【答案】四(4、Ⅳ都行) 氧化镁 质子数 ②③ 8
【解析】
(1)根据元素周期表可知,硅元素处于元素周期表中第四主族;
(2)X2+与O2-的核外电子排布相同,是两种粒子的核外电子数相等,O2-的核外有10个电子,所以X原子内有12个质子,X是镁,它与氧元素组成的化合物是氧化镁。
(3)一种元素与另一种元素最本质的区别是核内质子数不同。
(4)原子的最外层电子数相同,元素的化学性质相似,故选②③。
(5)根据粒子的核内有17个质子可知,该粒子是氯离子的结构示意图,氯原子最外层有7个电子,易得到一个电子形成离子,所以m=8。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
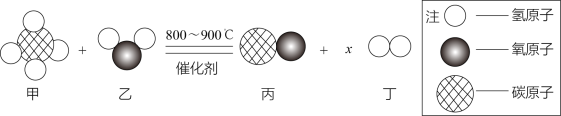
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】在汽油中加人适量乙醇(C2H5OH)作为汽车燃料,可节省石油资源并 适当减少汽车的尾气污染。
(1)乙醇俗称____________,写出乙醇燃烧的化学方程式____________。
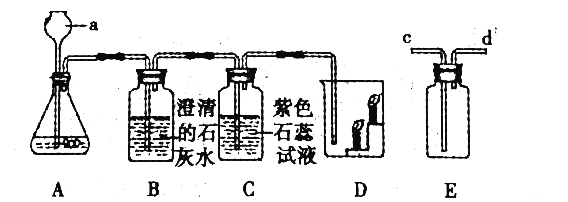
(2)单质C充分燃烧时生成CO2,不充分燃烧时生成CO。想知道乙醇的燃烧产物除含有H2O外,其它产物是什么?某同学设计了下列探究实验。
(提出问题)乙醇燃烧后的产物除含有H2O外其它产物是什么?
(查阅资料)浓硫酸具有吸水性,能干燥H2、CO2、CO等气体。
(猜想)猜想1:只含有CO2;
猜想2:只含有CO;
猜想3:含有_________。
(实验探究)限选试剂及仪器:浓硫酸、石灰水、氧化铜、酒精灯、广口瓶、导管、硬质玻璃管、胶塞等
实验步骤 | 实验现象 | 实验结果 | 结论 |
①将乙醇燃烧的产物通入盛有足量的石灰 水的广口瓶中。 | __________________。 | 说明有_________生成 | 猜想3 成立。 |
②继续将①中的气体通过盛有浓硫酸的广口瓶,再通过盛有热的氧化铜的玻璃管中 | __________________。 | 说明有_________生成 |
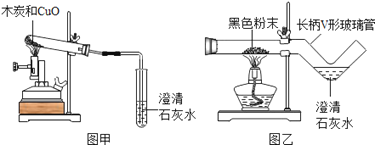
【题目】我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙)。化学兴趣小组采用图乙装置,开展以下探宄活动。
[提出问题]木炭与CuO反应所得红色固体中含有什么物质?
查阅资料
(1)木炭与CuO的反应是:C+2CuO![]() 2Cu+CO2↑ ,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O)。
2Cu+CO2↑ ,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O)。
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O
[作出猜想]红色固体的成分:①全部是Cu;②全部是Cu2O;③____________。
[实验探究]
(1)取木炭、CuO两种黑色粉末适量,再加少许CaCl2(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物:2分钟后,黑色粉末出现红热现象,同时澄清的石灰水____________,此时停止加热。
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
步骤 | 现象 | 结论 |
①取1.44g红色固体装入试管,滴入足量____________,充分反应。 | 红色固体部分减少,溶液变为 ____________色。 | 猜想____________错误 |
②滤出试管中残留的红色固体,洗涤干燥,称其质量为 1.04g | 猜想____________正确 |
[评价反思]
(1)使用图乙装置与使用甲装置相比,其优点是____________________(写出1条即可)。
(2)在铜的冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”(铁和硫酸铜溶液反应),该方法可用化学方程式表示为_________________。