题目内容
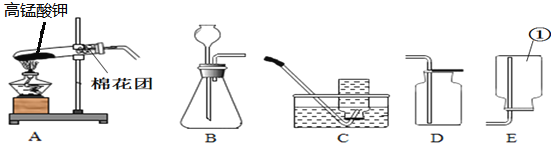
【题目】如图所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
(1)实验室利用高锰酸钾制备较为纯净的氧气,应选择的气体发生及收集装置_______(填写字母序号),反应的化学方程式为________。若用装置D收集氧气,验满的方法是_________。
(2)欲通过装置E用排空气法收集氧气,则气体应从__________(填写a或b)端通入;欲通过装置E用排水法收集氧气,先将瓶中装满水,再将气体从__________(填写a或b)端通入。
(3)固体过氧化钠与水反应的化学方程式如下:2Na2O2+2H2O=4NaOH+O2↑。若通过此反应制取氧气,若要控制滴加液体速率可选用__________装置作气体发生装置(填写字母序号)。
(4)氨气(NH3)是一种无色、有臭鸡蛋气味的气体,密度比空气小而且极容易于水。实验室制取甲烷气体常用氯化铵(固体)与氢氧化钙(固体)加热制得。则实验室制取氨气可选用的发生装置是__________,选用的收集并验满的装置是下图中的__________。(填写字母序号)

(5)利用铁丝的燃烧研究氧气性质实验时在集气瓶底部放入少量水或细砂的原因是___________。
(6)制取氧气前应先检查装置的气密性,若按照如图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是_____________。
A.将烧杯换位水槽
B.导管深入烧杯中的位置过深,气体无法逸出
C.将水换为冰水混合物
D.先用手握住试管外壁,再将导管另一端伸入水中
【答案】AF 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了 a b C A H 防止铁的是生成物下落,炸裂集气瓶 A
K2MnO4 + MnO2 + O2↑ 将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了 a b C A H 防止铁的是生成物下落,炸裂集气瓶 A
【解析】
(1)根据用高锰酸钾制氧气的原理,反应物的状态,反应的条件以及氧气的性质进行分析解答;
(2)根据氧气的密度和溶解性进行分析解答;
(3)化学方程式可知反应物的状态,反应的条件,选择发生装置;
(4)根据题中提供的反应原理判定反应物的状态,反应的条件,选择发生装置;氨气的性质选择收集装置;
(5)根据铁丝燃烧实验的操作注意点进行解答;
(6)根据检验气密性的原理进行分析。
(1)如果用高锰酸钾制氧气反应物的状态中固体,反应的条件是需要加热,反应装置选用A,氧气的密度大于空气,可用向上排空气法收集,氧气不易溶于水,可用排水法收集,收集装置可选用D或E或F,排水法收集的氧气比排空气法收集的氧气纯度高,所以用高锰酸钾制备较为纯净的氧气应选择的气体发生及收集装置是AF;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,该反应的化学方程式是2KMnO4![]() K2MnO4 + MnO2 + O2↑;氧气具有助燃性,能使带火星的木条复燃。氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;
K2MnO4 + MnO2 + O2↑;氧气具有助燃性,能使带火星的木条复燃。氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;
(2)氧气的密度比空气大,欲通过装置E用排空气法收集氧气,则气体应从a(长)管进入;氧气的密度比水小,氧气不易溶于水。欲通过装置E用排水法收集氧气,先将瓶中装满水,再将气体从b(短)管进入;
(3根据“固体过氧化钠与水反应的化学方程式如下:2Na2O2+2H2O=4NaOH+O2↑”可知,该反应的反应物状态是固体与液体,不需要加热,分液漏斗可以控制液体的滴加速率,可以控制反应的速率,所以可选用C装置作气体发生装置;
(4)根据“实验室制取甲烷气体常用氯化铵(固体)与氢氧化钙(固体)加热制得”可知,该反应的反应物状态是固体,需要加热,实验室制取氨气可选用的发生装置是A;氨气的密度比空气小,收集氨气从短管进入,倒扣的漏斗吸收多余的氨气更充分。故选H;
(5)铁丝燃烧的实验,在集气瓶底部放入少量水或细砂的原因是:防止铁的是生成物下落,而炸裂集气瓶;
(6)该实验检验气密性的原理是导管伸入水中,形成密闭体系,用手捂住试管,试管内气压增大,若装置不漏气,导管口形成气泡。A、将烧杯换成水槽,只是水量的多少,不影响气泡的产生,故A符合题意;B、若导管深入水中位置过深,水产生压强过大,气体无法逸出,影响气泡的产生,故B不符合题意;C、若将水换成冰水,导管中的气体遇冷,气压降低,影响气泡的产生,故C不符合题意; D、检验时应先将导管放入水中,再用手捂住试管壁,若先用手握住试管外壁,再将导管另一端伸入水中,影响气泡的产生,故D不符合题意。故选A。