题目内容
质量相等的锌、铝、铁,分别与足量稀硫酸反应,产生氢气的质量( )A.锌最多、铁最少
B.铝最多、锌最少
C.铁最多、铝最少
D.一样多
【答案】分析:利用锌、铝、铁质量相等的条件,假设三种金属的质量都为M,根据三种金属与稀硫酸反应的化学方程式,用M表示出所得氢气的质量,并比较三种金属产生氢气质量的大小.
解答:解:假设锌、铝、铁的质量都为M,与足量稀硫酸反应后所得氯气质量分别为z、a、f
Zn+H2SO4═ZnSO4+H2↑
65 2
M z
 =
= z=
z=
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
M a
 =
= a=
a=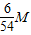 =
=
Fe+H2SO4═FeSO4+H2↑
56 2
M f
 =
= f=
f=
∵ >
> >
>
∴产生氢气的质量铝最多、锌最少
故选B.
点评:根据以上计算结果,可推断出一定质量金属完全反应所放出氢气的质量= ×金属的质量,使用该公式可简化计算过程.
×金属的质量,使用该公式可简化计算过程.
解答:解:假设锌、铝、铁的质量都为M,与足量稀硫酸反应后所得氯气质量分别为z、a、f
Zn+H2SO4═ZnSO4+H2↑
65 2
M z
 =
= z=
z=
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
M a
 =
= a=
a=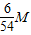 =
=
Fe+H2SO4═FeSO4+H2↑
56 2
M f
 =
= f=
f=
∵
 >
> >
>
∴产生氢气的质量铝最多、锌最少
故选B.
点评:根据以上计算结果,可推断出一定质量金属完全反应所放出氢气的质量=
 ×金属的质量,使用该公式可简化计算过程.
×金属的质量,使用该公式可简化计算过程. 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
质量相等的锌、铝、铁,分别与足量稀硫酸反应,产生氢气的质量( )
| A、锌最多、铁最少 | B、铝最多、锌最少 | C、铁最多、铝最少 | D、一样多 |