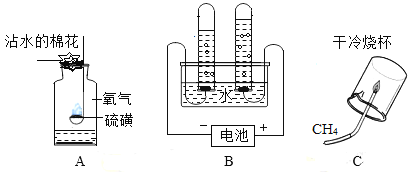
题目内容
【题目】某兴趣小组的同学在实验室用含有少量生石灰的氯化钠固体配制一定质量分数的氯化钠溶液。实验步骤如下图所示,请回答:
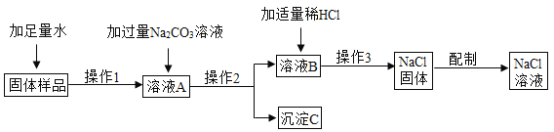
(1)在“固体样品”中加入水时所发生反应的化学方程式为________。
(2)“溶液B”中所含溶质为________(填化学式)。
(3)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有________。
(4)加入“适量稀HCl”的目的是________。
(5)“操作3”的名称是________。
(6)①用提纯的NaCl配制200 g 0.9%的生理盐水,需要NaCl的质量为__________ g。
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应________。
A 增加适量砝码 B 减少适量氯化钠固体 C 调节平衡螺母
③在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会________(填“偏高”、“偏低”、或“无影响”)。
【答案】![]() NaCl、NaOH、Na2CO3 漏斗 除去溶液中的NaOH和Na2CO3 蒸发结晶 1.8 B 偏高
NaCl、NaOH、Na2CO3 漏斗 除去溶液中的NaOH和Na2CO3 蒸发结晶 1.8 B 偏高
【解析】
氧化钙和水反应生成氢氧化钙,碳酸钠和氢氧化钙生成碳酸钙沉淀和氢氧化钠,氢氧化钠和稀盐酸反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳。
(1)固体样品中含有少量氧化钙,在“固体样品”中加入水时所发生反应是氧化钙和水反应生成氢氧化钙,反应的化学方程式为![]() 。
。
(2)溶液A中碳酸钠和氢氧化钙生成碳酸钙沉淀和氢氧化钠,过滤后,“溶液B”中所含溶质为氯化钠、氢氧化钠和过量的碳酸钠,化学式为NaCl、NaOH、Na2CO3。
(3)操作2是过滤操作,在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有漏斗。
(4)氢氧化钠和稀盐酸反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,故加入“适量稀HCl”的目的是除去溶液中的NaOH和Na2CO3。
(5)溶液B中溶质是氯化钠、氢氧化钠和过量的碳酸钠,氢氧化钠和碳酸钠的溶解度随温度的升高而增大,氯化钠的溶解度受温度的影响较小,“操作3”是得到氯化钠,名称是蒸发结晶。
(6)①用提纯的NaCl配制200 g 0.9%的生理盐水,需要NaCl的质量为![]() 。
。
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,说明药品加的太多了,应减少适量氯化钠固体,故选B。
③在用量筒量取所需水的过程中,若俯视读数,读数偏大,实际量取水的体积偏小,溶液的质量减少,而其余操作均正确,这样配得的溶液的溶质质量分数会偏高。