题目内容
【题目】现有下列仪器或装置,请回答下列问题:
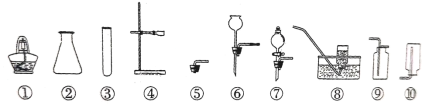
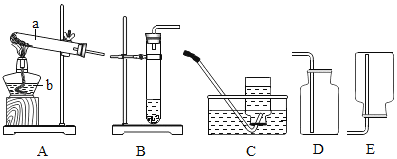
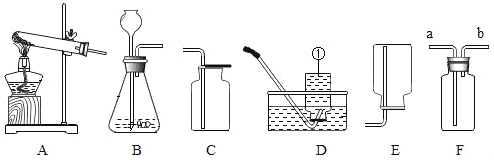
①仪器①的名称是___________;用______ (填仪器名称)取废铁屑放入试管。可以用上图A~E仪器组装成制气体装置:用废铁屑与稀盐酸反应制取H2,应选_________(填字母)。
②F装置锥形瓶内装有二氧化锰和双氧水,请写出锥形瓶中发生反应的化学方程式:_______。请预测本实验过程中,F装置中无水硫酸铜是否会变蓝?______(填“是”或“否”)。
③选择气体收集方法时, 必须考虑的气体性质有________(填序号) 。
A.颜色 B.密度 C.溶解性 D.可燃性
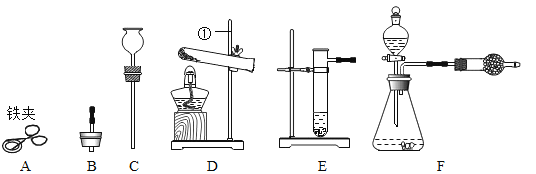
④若用下图装置且正放在桌上进行“排空气法”收集制取的H2,请把图中的“导气管”补画完整。______
【答案】铁架台 药匙或纸槽 CE 或ACE 2H2O2![]() 2H2O+O2↑ 是 BC
2H2O+O2↑ 是 BC 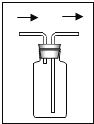
【解析】
①根据实验室常用仪器的认识,①所示仪器为铁架台,取用粉末状固体药品放入试管,可以用药匙或纸槽,用废铁屑与稀盐酸反应制取H2,为固-液常温型装置,制气装置最好选用仪器为:CE或ACE;
②用二氧化锰和双氧水制氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;无水硫酸铜遇水会变蓝,因为氧气用双氧水制得,会带有水蒸气,所以无水硫酸铜会变蓝;
2H2O+O2↑;无水硫酸铜遇水会变蓝,因为氧气用双氧水制得,会带有水蒸气,所以无水硫酸铜会变蓝;
③收集气体的方法有排水法和排空气法,是根据气体的溶解性和密度确定的,选择气体收集方法时,必须考虑的气体的溶解性和密度,故选BC;
④用洗气瓶收集气体,密度比空气小的短进长出,所以如图:
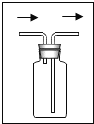 。
。

【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。