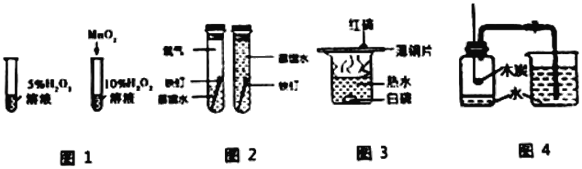
题目内容
【题目】用化学用语表示:
(1)两个汞原子____(2)三个铝离子____(3)两个氯气分子___(4)氯化亚铁中铁元素的化合价____(5)酒精____(6)氧化镁中的阳离子____(7)画出氧的离子结构示意图________(8)地壳中含量最高的非金属元素与含量第二非金属元素形成的化合物是_____
【答案】2Hg 3Al3+ 2Cl2 ![]() C2H5OH Mg2+
C2H5OH Mg2+ 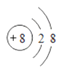 SiO2
SiO2
【解析】
(1)两个汞原子的符号为2Hg,故填2Hg。
(2)三个铝离子的符号为3Al3+,故填3Al3+。
(3)两个氯气分子的符号为2Cl2,故填2Cl2。
(4)氯化亚铁中铁元素的化合价为+2价,故标为![]() 。
。
(5)酒精的化学式为C2H5OH,故填C2H5OH。
(6)氧化镁中的阳离子为镁离子,其符号为Mg2+,故填Mg2+。
(7)氧离子的核内有8个质子,核外有两个电子层,最外层电子数为8,故氧的离子结构示意图标为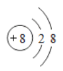 。
。
(8)地壳中含量最高的非金属元素是氧元素,含量第二非金属元素是硅元素,两种元素形成的化合物是二氧化硅,其化学式为SiO2,故填SiO2。

【题目】周末,小晋和家人在饭店聚餐时,有一道菜“锡纸烤鱼”引起他的兴趣,当服务员拨开锡纸时便闻到一服鱼的鲜香味,请用分子观点解释此现象_____。小晋将"锡纸”拿到学校,进行了如下探究:

(一) 他想知道“锡纸”是否能燃烧。将“锡纸"剪成一段两头宽中同窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。
从燃烧的条件开始“锡纸”不燃烧但接入电池正负极发生短路却能燃烧的原因是_____。
(二)小晋对“锡纸”中金属的成分是什么产生了好奇。
他查阅资料得知:①“锡纸”是锡箔或铝箔;②锡(Sn)与酸或金属化合物溶液反应生成+2价锡的化合物。
[提出猜想]猜想I:“锡纸”中的金属是锡;猜想II:“锡纸”中的金属是铝。
[进行实验]设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取打磨后的“锡纸"片于试管中,加入______。 | 溶液由浅绿色变为无色 | 猜想_____ (选填“I”或“II”)成立;反应的化学方程为_____。 |
[交流讨论]
(1)实验中打磨“锡纸”的目的是______。
(2)为验证该“锡纸”中的金属与铜的金属活动性强弱,可以选择下列试剂中的____。
A.氯化铜溶液 B.氯化镁溶液 C.硫酸钠溶液 D.稀硫酸
(3)生活中使用“锡纸”时需要注意的是_______。(合理即可)
【题目】下列对一些事实的解释不正确的是![]()
![]()
事实 | 解释 | |
A | 物质的热胀冷缩 | 分子或原子的大小随温度的改变而改变 |
B | 一氧化碳有可燃性,而二氧化碳不具有可燃性 | 物质组成元素虽然相同,但分子结构也不同 |
C | 水电解产生氢气和氧气 | 分子在化学变化中是可以再分的 |
D |
| 一般都不支持燃烧 |
A. A B. B C. C D. D