题目内容
【题目】我们的生活用品,大都是由金属材料制成的。
(1)金属铜常用来做导线,是利用了铜良好的延展性和_____性。
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜_____纯铜(填“>”、“<”或“=”)
(3)铝制品具有很好的抗腐蚀性能,其原因是_____(用化学方程式表示)。
(4)将一定量的锌粉加入到硫酸亚铁、硫酸铜的混合溶液中,一段时间后过滤,向滤渣中加入稀盐酸,观察到有气泡产生,则滤液中一定含有的溶质有_____。
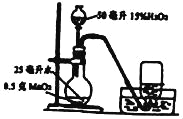
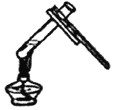
(5)小倩同学根据工业炼铁的原理设计了如图所示装置进行实验。
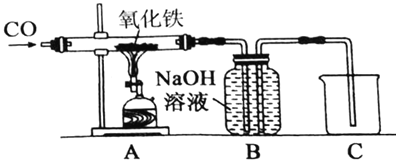
①实验开始时,应先给氧化铁加热还是通一氧化碳?_____。
②加热一段时间后,A装置玻璃管内的现象是_____,反应的化学方程式为_____。
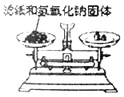
③你认为该装置是否需要添加尾气处理装置并说明理由_____。
【答案】导电 > 4Al+3O2═2Al2O3 硫酸锌 先通一氧化碳 红棕色粉末变黑; Fe2O3+3CO![]() 2Fe+3CO2 不需要,因为未反应的CO进入B装置中,不会逸散到空气中(合理即可)
2Fe+3CO2 不需要,因为未反应的CO进入B装置中,不会逸散到空气中(合理即可)
【解析】
(1)金属铜常用来做导线,是利用了铜良好的延展性和导电性,故填:导电;
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜大于纯铜;故填:>;
(3)在通常情况下,铝能和氧气反应生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3;故填:4Al+3O2═2Al2O3;
(4)根据金属活动顺序表可知,锌比铁活泼,铁比铜活泼。所以,加入一定量的锌粉,首先锌粉和硫酸铜溶液反应,置换出单质铜,如果锌粉足量可以继续与硫酸亚铁反应置换出铁。由题意可知,向滤出的固体中滴加稀硫酸,有气泡产生,说明固体中含有和稀硫酸反应的金属,由题可知,金属可能是铁或铁和锌。由于锌能与硫酸铜和硫酸亚铁反应,滤液中一定含有硫酸锌;故填:硫酸锌;
(5)①CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此应先通入CO排尽玻璃管中的空气,然后再点燃加热氧化铁的酒精灯,故实验开始时应先通CO再加热;故填:先通一氧化碳;
②A装置中一氧化碳与氧化铁(红棕色)反应生成铁(黑色)和二氧化碳,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;故填:红棕色粉末变黑;Fe2O3+3CO
2Fe+3CO2;故填:红棕色粉末变黑;Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
③尾气中的二氧化碳被氢氧化钠溶液吸收,而一氧化碳与氢氧化钠溶液不反应,由装置B可知,B中的溶液被一氧化碳气体排出瓶外,流入烧杯中,而一氧化碳就存在于装置B中,所以无需添加尾气处理装置;故填:不需要,因为未反应的CO进入B装置中,不会逸散到空气中(合理即可)。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】某化学实验小组同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集气,得到的气体能使带火星的竹签复燃,为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
(1)(设计实验)小组A同学设计了如图的装置,该装置的圆底烧瓶中放入25毫升水的目的是_______,放入MnO2的目的是_______,写出烧瓶中发生的反应的方程式_______。
(2)(实验研究)第一组实验:取3只集气瓶,编号为①②③,分别装入15%、30%和45%的水,盖上盖玻片倒置在水槽中。当气泡_______放出后,导管口伸入集气瓶把其中的水全部排出,将相同的3支带火星竹签分别插入①~③号瓶中,记录实验现象。
获得第一组实验现象后,该小组同学A又做了第二组实验,并记录实验现象,两组实验数据和现象见表:
实验分组 | 第一组 | 第二组 | ||||
实验序号 | ⑥ | |||||
集气瓶装水的体积分数 (%) | 15 | 30 | 45 | 34 | 38 | 42 |
带火星竹签状况 | 亮 | 很亮 | 复燃 | 很亮 | 复燃 | 复燃 |
(3)得出上述两组实验现象后,小组B同学认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是_______%
(4)(实验结论)再经过数次实验并计算后得出:能使带火星竹签复燃的氧气含量最小值为48.7%.请你写出计算过程的计算式_______。 (恰好复燃时集气瓶装水的体积分数是X%)
(5)(继续探究)小组C同学认为采用该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进的措施_______。