题目内容
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题:
(1)从图中看出生成沉淀的最大质量是______g.
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原因是______.
(3)计算原滤液中氯化钙的质量分数.

【答案】分析:(1)根据图示信息找出沉淀的最大质量;
(2)根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;
(3)根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.
解答:解:(1)由图可以看出,生成沉淀的最大质量是5g;
(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应;
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl …(1分)
111 100
x 5g
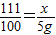
x=5.55g
故原滤液中氯化钙的质量分数为: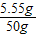 ×100%=11.1%
×100%=11.1%
答:原滤液中氯化钙的质量分数是11.1%.
故答案为:(1)5;(2)稀盐酸先与碳酸钠反应;(3)11.1%;
点评:此题是对物质分析及图象识别考查题,解题的关键是能对表格及图象有明确的认识,解决此题对培养学生良好的分析问题的能力有一定帮助.
(2)根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;
(3)根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.
解答:解:(1)由图可以看出,生成沉淀的最大质量是5g;
(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应;
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl …(1分)
111 100
x 5g
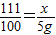
x=5.55g
故原滤液中氯化钙的质量分数为:
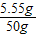 ×100%=11.1%
×100%=11.1%答:原滤液中氯化钙的质量分数是11.1%.
故答案为:(1)5;(2)稀盐酸先与碳酸钠反应;(3)11.1%;
点评:此题是对物质分析及图象识别考查题,解题的关键是能对表格及图象有明确的认识,解决此题对培养学生良好的分析问题的能力有一定帮助.

练习册系列答案
相关题目
 (2012?肇庆)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.
(2012?肇庆)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示. (2013?平江区二模)实验室用过量的稀盐酸和大理石制取CO2,待完全反应后过滤,称得滤液质量为30g,向其中逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题:
(2013?平江区二模)实验室用过量的稀盐酸和大理石制取CO2,待完全反应后过滤,称得滤液质量为30g,向其中逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题: (2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.
(2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.