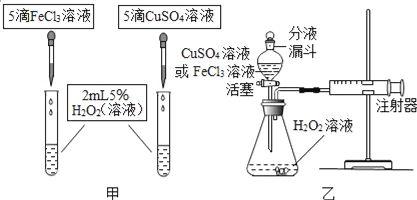
题目内容
【题目】铁及其化合物有广泛的应用.
(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是________(填字母).
A. 单质 B.元素 C.原子
(2)铁制炊具加热食物,说明铁具有的性质是_______.
(3)铁与铬、镍等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料.以上叙述中不涉及到_______(填字母).
A.合金 B.无机非金属材料 C.合成材料 D.复合材料
(二)草酸亚铁晶体组成的测定
草酸亚铁晶体(化学组成为FeC2O4·xH2O)是一种淡黄色晶体粉末.
【查阅资料】Ⅰ. CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉;
Ⅱ. FeO和Fe3O4都是黑色物质,FeO在空气中不稳定,易被氧化.
草酸亚铁晶体受热分解生成四种氧化物,为确定分解产物及x的值,设计了如下实验进行探究:(装置C、D、E中药品均足量)
【实验设计】
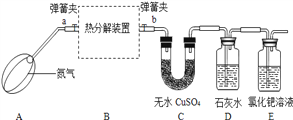
【实验步骤】
(1)连接装置,___________;
(2)称装置B中固体质量、装置C的质量;
(3)在装置B中装入一定质量的草酸亚铁晶体,打开弹簧夹a、b,鼓入一段时间氮气;
(4)用酒精灯加热B装置,直至晶体完全变成黑色,停止加热;
(5)继续通氮气至装置冷却,关闭弹簧夹a、b;
(6)再次称量装置B中固体质量、装置C的质量.
【进行实验】该小组同学按上述实验步骤进行实验,并记录了如下数据:
装置B中固体质量(/g) | 装置C的质量(/g) | |
实验前 | 9.0 | 168.2 |
实验后 | 3.6 | 170.0 |
【实验分析及数据处理】
(1)加热前先鼓入一段时间氮气的目的是_______;
(2)实验过程中,装置C中固体变为蓝色,说明草酸亚铁晶体分解生成了________,FeC2O4·xH2O中x的值为____;实验结束后若不继续通氮气,X值____(填“偏大”、“不变”或“偏小”);
(3)装置D中石灰水变浑浊,说明草酸亚铁晶体分解生成了______;
(4)装置E出现黑色物质,说明草酸亚铁晶体分解生成了______;同时装置E还具有的作用是______;
(5)根据上表数据,计算反应后装置B中残留黑色物质的化学式______;
(6)实验后,装置B中固体的颜色由淡黄色变成黑色,
写出草酸亚铁晶体受热分解的化学方程式: ___;
【定量研究】
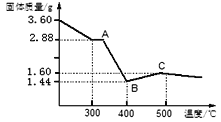
取3.60g草酸亚铁晶体在坩埚中敞口充分加热,固体质量随温度变化的曲线如下图所示,写出BC段发生反应的化学方程式:________.
【答案】 B 导热性 B 检查装置气密性 排尽装置内空气,(防爆炸或排尽装置内空气,防止FeO被氧化等) H2O 2 偏小 CO2 CO 吸收CO,防止污染大气 FeO FeC2O4·2H2O![]() FeO+ CO↑+CO2↑ +2H2O 4FeO+O2===2Fe2O3
FeO+ CO↑+CO2↑ +2H2O 4FeO+O2===2Fe2O3
【解析】(一)(1)单独说名称一般指元素。(2)铁有良好的传热性,可制成炊具加热食物。(3)不锈钢属于合金,聚乙烯纤维属于合成材料,耐酸防护服材料属于复合材料,故选B。(二)【实验步骤】(1)有气体参加或生成时,必须检查装置的气密性。【实验分析及数据处理】
(1)加热前先鼓入一段时间氮气的目的是排尽装置内空气,防止对实验的干扰。(2)无水硫酸铜遇水变蓝。装置C反应前后的差量是生成水的质量:170.0g-168.2g=1.8g
FeC2O4·xH2O ------xH2O
144+18x 18x
9g 1.8g
![]() =
=![]() 解得x=2g
解得x=2g
实验结束后若不继续通氮气,X值偏小。(3)装置D中石灰水变浑浊,说明草酸亚铁晶体分解生成了二氧化碳。(4)因为CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,故装置E出现黑色物质,说明草酸亚铁晶体分解生成了CO。同时装置E还能吸收CO,防止污染大气。
(5)9gFeC2O4·2H2O中铁元素的质量为:9g×![]() =2.8g,根据质量守恒定律,反应后装置B中残留黑色物质中铁元素的质量为2.8g,设残留黑色物质的化学式为FexOy,
=2.8g,根据质量守恒定律,反应后装置B中残留黑色物质中铁元素的质量为2.8g,设残留黑色物质的化学式为FexOy,
![]() ×3.6g=2.8g,解得
×3.6g=2.8g,解得![]() =1,故残留黑色物质的化学式为FeO (6)草酸亚铁晶体受热分解生成水、二氧化碳、一氧化碳、氧化亚铁,反应的化学方程式:FeC2O4·2H2O
=1,故残留黑色物质的化学式为FeO (6)草酸亚铁晶体受热分解生成水、二氧化碳、一氧化碳、氧化亚铁,反应的化学方程式:FeC2O4·2H2O![]() FeO+ CO↑+CO2↑ +2H2O 【定量研究】因为FeO在空气中不稳定,易被氧化,BC段固体质量增加,故发生反应的化学方程式: 4FeO+O2===2Fe2O3
FeO+ CO↑+CO2↑ +2H2O 【定量研究】因为FeO在空气中不稳定,易被氧化,BC段固体质量增加,故发生反应的化学方程式: 4FeO+O2===2Fe2O3

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案