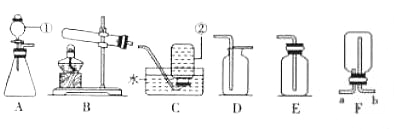
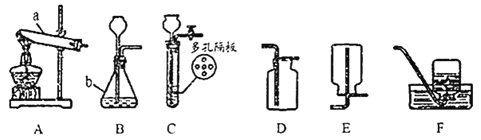
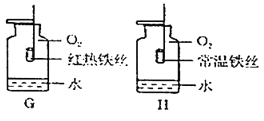
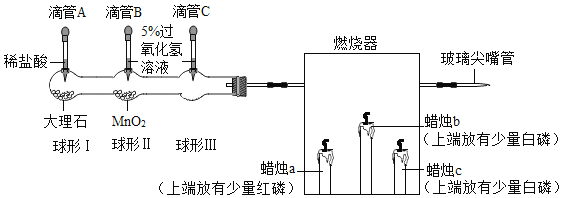
题目内容
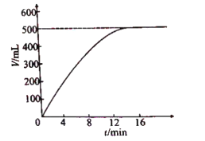
【题目】研究小组为了测定某氯酸钾样品中氯酸钾的含量,称取2.00g该样品,加热,收集产生的氧气,在该条件下测得的氧气体积与反应时间的关系如下图所示,已知:
①2KCIO3==2KCl+3O2↑
②该条件下氧气的密度为1.40g/L
③样品中杂质不参与化学反应
计算:(1)完全反应后产生氧气的质量为_____g。
(2)样品中氯酸钾的质量____(精确到0.1g)。
【答案】0.7g 1.8g
【解析】
(1)由题可知生成氧气的体积为500mL=0.5L,根据质量=体积×密度可知生成氧气质量为0.5L×1.40g/L=0.7g,故填 0.7g;
(2)已知生成氧气的质量,根据化学方程式求反应物质量,设样品中氯酸钾的质量为x,

![]() =
=![]() 解得x≈1.8g,故填1.8g;写出答:完全反应后产生氧气的质量为0.7g,样品中氯酸钾的质量为1.8g。
解得x≈1.8g,故填1.8g;写出答:完全反应后产生氧气的质量为0.7g,样品中氯酸钾的质量为1.8g。

练习册系列答案
相关题目