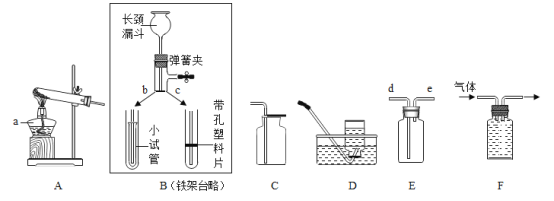
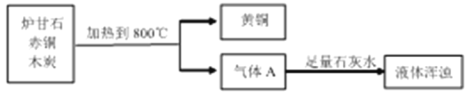
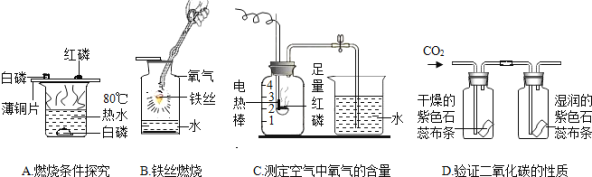
题目内容
【题目】取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为16.4g。计算:
(1)生成氧气的质量________。
(2)原混合物中二氧化锰的质量分数_______(精确到0.1%)
【答案】9.6g 5.8%
【解析】
(1)利用质量守恒定律,由反应前后固体物质的质量差,可求得放出气体氧气的质量;
(2)根据反应的化学方程式,利用生成氧气的质量可计算生成氯化钾的质量,然后计算二氧化锰的质量,从而计算二氧化锰的质量分数。
(1)待反应至不再有气体生成后,制取氧气的质量为:26g-16.4g=9.6g;
(2)设生成氯化钾的质量为x。
![]()
x=14.9g
所以二氧化锰的质量为:16.4g-14.9g=1.5g
原混合物中二氧化锰的质量分数=![]() =5.8%
=5.8%
答:(1)生成氧气的质量为9.6g;(2)原混合物中二氧化锰的质量分数5.8%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目