题目内容
(2012?浦口区一模)对实验室制取CO2反应后滤液的相关探究:
(1)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的pH=2.则滤液呈
(2)因后续实验需要,现要配制质量分数为26.5%的碳酸钠溶液200g,
①计算:需要碳酸钠固体的质量为
②称量:调节托盘天平平衡后,将
③溶解:用量筒量取所需的水,倒入装有碳酸钠固体的烧杯里,用玻璃棒
④存储:把配好的溶液装入试剂瓶,塞好橡皮塞并
(3)取50g滤液,逐滴滴入上述配制的碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如图1[pH为纵坐标,时间s(秒)为横坐标]:
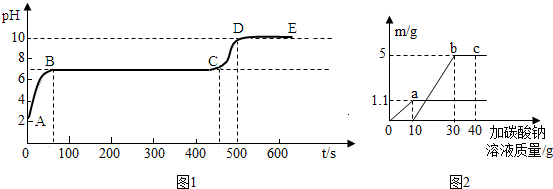
①写出AB段内有关化学方程式
②写出BC“平台”段现象
③CD段上升的原因是:
(4)根据上述实验测得的另一组数据绘制出如图2(纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量),请计算出原滤液中氯化钙的质量分数.
(1)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的pH=2.则滤液呈
酸
酸
性,滤液中所含的主要离子有H+、Ca2+、Cl
H+、Ca2+、Cl
.(2)因后续实验需要,现要配制质量分数为26.5%的碳酸钠溶液200g,
①计算:需要碳酸钠固体的质量为
53
53
g;水的体积为147
147
mL(水的密度近似看作1g/cm3)②称量:调节托盘天平平衡后,将
烧杯
烧杯
放在托盘天平的左盘,称量其质量.然后在右盘添加砝码
砝码
.最后加碳酸钠固体,直至天平平衡.③溶解:用量筒量取所需的水,倒入装有碳酸钠固体的烧杯里,用玻璃棒
搅拌
搅拌
,使其溶解,并冷却至室温.④存储:把配好的溶液装入试剂瓶,塞好橡皮塞并
贴上标签
贴上标签
,放到指定的地方.(3)取50g滤液,逐滴滴入上述配制的碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如图1[pH为纵坐标,时间s(秒)为横坐标]:

①写出AB段内有关化学方程式
Na2CO3+2HCl═2NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
,CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
,Na2CO3+CaCl2═CaCO3↓+2NaCl
Na2CO3+CaCl2═CaCO3↓+2NaCl
.②写出BC“平台”段现象
出现白色沉淀
出现白色沉淀
.③CD段上升的原因是:
碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强
碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强
.(4)根据上述实验测得的另一组数据绘制出如图2(纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量),请计算出原滤液中氯化钙的质量分数.
分析:(1)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化碳;根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=2的溶液为酸性溶液,可以据此解答该题;
(2)①计算时根据溶质质量分数的计算公式计算溶质和溶剂的质量;
②用天平称量物质时,应该将物品放在左盘,砝码放在右盘,可以据此解答;
③溶解时为了加速溶解,通常用玻璃棒搅拌来加速溶解;
④为了方便识别试剂,应该将试剂瓶贴上标签,可以据此解答;
(3)①根据上述分析可以知道,在溶液中含有氯化钙、盐酸,所以将碳酸钠溶液滴入溶液中,即AB段发生的反应为:碳酸钠和氯化钙溶液的反应、碳酸钙和盐酸反应、碳酸钠和盐酸的反应,可以据此写出它们反应的化学方程式;
②BC段的pH=7,且不再发生改变,则可以判断盐酸已被完全反应,即该段发生的反应为碳酸钠和氯化钙的反应,所以可以据此判断该段内的实验现象;
③CD段pH值升高,说明溶液中的氯化钙已被完全反应,而碳酸钠溶液呈碱性,可以据此解答该题;
(4)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入10g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为5g,可以据此结合化学方程式求算出氯化钙的质量.进而完成解答即可.
(2)①计算时根据溶质质量分数的计算公式计算溶质和溶剂的质量;
②用天平称量物质时,应该将物品放在左盘,砝码放在右盘,可以据此解答;
③溶解时为了加速溶解,通常用玻璃棒搅拌来加速溶解;
④为了方便识别试剂,应该将试剂瓶贴上标签,可以据此解答;
(3)①根据上述分析可以知道,在溶液中含有氯化钙、盐酸,所以将碳酸钠溶液滴入溶液中,即AB段发生的反应为:碳酸钠和氯化钙溶液的反应、碳酸钙和盐酸反应、碳酸钠和盐酸的反应,可以据此写出它们反应的化学方程式;
②BC段的pH=7,且不再发生改变,则可以判断盐酸已被完全反应,即该段发生的反应为碳酸钠和氯化钙的反应,所以可以据此判断该段内的实验现象;
③CD段pH值升高,说明溶液中的氯化钙已被完全反应,而碳酸钠溶液呈碱性,可以据此解答该题;
(4)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入10g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为5g,可以据此结合化学方程式求算出氯化钙的质量.进而完成解答即可.
解答:解:(1)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化碳,其中氯化钙在溶液中以钙离子和氯离子的形式存在,而水以水分子的形式存在,二氧化碳逸出;根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=2的溶液为酸性溶液;
(2)①现要配制质量分数为26.5%的碳酸钠溶液200g,需要碳酸钠固体的质量为:200g×26.5%=53g;水的质量为:200g-53g=147g,即为147mL;
②用天平称量物质时,对于有腐蚀性的固体应该在烧杯中称量,应该将烧杯放在左盘,然后将砝码放在右盘,调节游码,向左盘加入药品直至天平平衡;
③溶解时为了加速溶解,通常用玻璃棒搅拌来加速溶解;
④为了方便识别试剂,应该将试剂瓶贴上标签;
(3)①根据上述分析可以知道,在溶液中含有氯化钙、盐酸,所以将碳酸钠溶液滴入溶液中,即AB段发生的反应为:碳酸钠和氯化钙溶液的反应、碳酸钙和盐酸反应、碳酸钠和盐酸的反应,可以据此写出它们反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑、Na2CO3+CaCl2═CaCO3↓+2NaCl;
②BC段的pH=7,且不再发生改变,则可以判断盐酸已被完全反应,即该段发生的反应为碳酸钠和氯化钙的反应,所以产生的实验现象为产生白色沉淀;
③CD段pH值升高,说明溶液中的氯化钙已被完全反应,而碳酸钠溶液呈碱性,当氯化钙反应完后继续滴加碳酸钠溶液,溶液会显碱性,故pH会逐渐增大.
(4)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入10g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为5g;
设氯化钙的质量为x,则:
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 5g
=
解得:x=5.55g
原滤液中氯化钙的质量分数为:
×100%=11.1%.
答:原滤液中氯化钙的质量分数为11.1%.
故答案为:(1)酸;H+、Ca2+、Cl-;
(2)①53;147;
②烧杯;砝码;
③搅拌;
④贴上标签;
(3)①Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑;Na2CO3+CaCl2═CaCO3↓+2NaCl;
②出现白色沉淀;
③碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强;
(4)11.1%.
(2)①现要配制质量分数为26.5%的碳酸钠溶液200g,需要碳酸钠固体的质量为:200g×26.5%=53g;水的质量为:200g-53g=147g,即为147mL;
②用天平称量物质时,对于有腐蚀性的固体应该在烧杯中称量,应该将烧杯放在左盘,然后将砝码放在右盘,调节游码,向左盘加入药品直至天平平衡;
③溶解时为了加速溶解,通常用玻璃棒搅拌来加速溶解;
④为了方便识别试剂,应该将试剂瓶贴上标签;
(3)①根据上述分析可以知道,在溶液中含有氯化钙、盐酸,所以将碳酸钠溶液滴入溶液中,即AB段发生的反应为:碳酸钠和氯化钙溶液的反应、碳酸钙和盐酸反应、碳酸钠和盐酸的反应,可以据此写出它们反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑、Na2CO3+CaCl2═CaCO3↓+2NaCl;
②BC段的pH=7,且不再发生改变,则可以判断盐酸已被完全反应,即该段发生的反应为碳酸钠和氯化钙的反应,所以产生的实验现象为产生白色沉淀;
③CD段pH值升高,说明溶液中的氯化钙已被完全反应,而碳酸钠溶液呈碱性,当氯化钙反应完后继续滴加碳酸钠溶液,溶液会显碱性,故pH会逐渐增大.
(4)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入10g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为5g;
设氯化钙的质量为x,则:
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 5g
| 111 |
| 100 |
| x |
| 5g |
解得:x=5.55g
原滤液中氯化钙的质量分数为:
| 5.55g |
| 50g |
答:原滤液中氯化钙的质量分数为11.1%.
故答案为:(1)酸;H+、Ca2+、Cl-;
(2)①53;147;
②烧杯;砝码;
③搅拌;
④贴上标签;
(3)①Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑;Na2CO3+CaCl2═CaCO3↓+2NaCl;
②出现白色沉淀;
③碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强;
(4)11.1%.
点评:解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理,以及计算所要用到的数据;再根据实验的反应原理,利用所称取的样品进行实验探究,分析推断出该物质的组成成分;然后,根据化学方程式计算出该样品中某一成分的质量;然后,将所求的该成分的质量除以所取样品的质量,再乘以100%,得出所要探究的物质中该成分的含量;进而推算出其它成分的含量.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 (2012?浦口区一模)新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,在反应中M的化合价不发生改变.转化流程如图所示,已知MFe2Oy中Fe为+3价.下列说法中,正确的是( )
(2012?浦口区一模)新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,在反应中M的化合价不发生改变.转化流程如图所示,已知MFe2Oy中Fe为+3价.下列说法中,正确的是( )

