题目内容
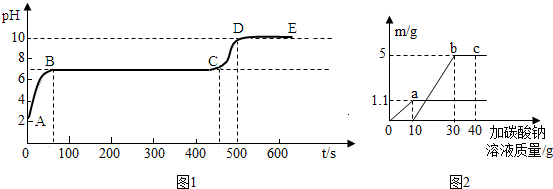
(2012?浦口区一模)图1中用字母表示的10种物质是由H、C、O、Ca、Cl、Fe中的一种或几种元素组成,它们是初中化学常见的物质.题中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.已知圈Ⅰ中的转化均是分解反应,圈Ⅱ中的转化均是化合反应.
(1)Y是大理石的主要成分,则Y的化学式为
(2)N和F是常见的非金属单质.化合物D和E的元素种类相同,请写出E+N→D反应的化学方程式
(3)从上述十种物质中任选物质,按图2所示装置进行实验.当胶头滴管中的液体滴入瓶中,U型管中的液面发生了明显变化.
若a处液面降低,则符合此现象的物质组合:液体
若a处液面升高,则符合此现象的化学反应方程式:

(1)Y是大理石的主要成分,则Y的化学式为
CaCO3
CaCO3
.(2)N和F是常见的非金属单质.化合物D和E的元素种类相同,请写出E+N→D反应的化学方程式
2CO+O2
2CO2
| ||
2CO+O2
2CO2
,E+M→D反应的化学方程式
| ||
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)从上述十种物质中任选物质,按图2所示装置进行实验.当胶头滴管中的液体滴入瓶中,U型管中的液面发生了明显变化.
若a处液面降低,则符合此现象的物质组合:液体
H2O2或者HCl
H2O2或者HCl
、物质Fe2O3或CaCO3
Fe2O3或CaCO3
.若a处液面升高,则符合此现象的化学反应方程式:
CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3

分析:题目给出了元素限制,反应类型限制,且物质为10种,看起来很复杂.不妨从给出的问题中需要解决的方案.Y是大理石的主要成分,即为碳酸钙,而D和X能够反应生成碳酸钙,且碳酸钙和Z能够反应得到D,可以看出D为二氧化碳,而DE组成元相同,则E为一氧化碳.E转化为D有两种方式,一是和单质N反应生成二氧化碳,所以N为氧气;而和M反应,就应该是氧化性金属氧化物反应,M可以为四氧化三铁、氧化铁、氧化亚铁等.由于氧气和单质F反应可以得到二氧化碳或者一氧化碳,所以单质F只能为碳.AB都能生成氧气,且A能够成B,所以A为过氧化氢,B为水.结合反应类型,整个分析符合题意,圈I全是分解反应,圈II全是化合反应.
解答:解:Y是大理石的主要成分,即为碳酸钙,而D和X能够反应生成碳酸钙,且碳酸钙和Z能够反应得到D,可以看出D为二氧化碳,而DE组成元相同,则E为一氧化碳.E转化为D有两种方式,一是和单质N反应生成二氧化碳,所以N为氧气;而和M反应,就应该是氧化性金属氧化物反应,M可以为四氧化三铁、氧化铁、氧化亚铁等.由于氧气和单质F反应可以得到二氧化碳或者一氧化碳,所以单质F只能为碳.AB都能生成氧气,且A能够成B,所以A为过氧化氢,B为水.结合反应类型,整个分析符合题意,圈I全是分解反应,圈II全是化合反应.对应图为:
(1)Y是大理石的主要成分,为碳酸钙,在碳酸钙中钙元素为+2价,而碳酸根显-2价,根据化合物中化合价的代数和为零,可得其化学式为 CaCO3.
(2)由于N为氧气,而E为一氧化碳E+N→D生成的是二氧化碳,化学方程式 2CO+O2
2CO2;一氧化碳和铁的氧化物反应均能生成二氧化碳和铁,以氧化铁为例的化学方程式为 3CO+Fe2O3
2Fe+3CO2.
(3)从上述十种物质中任选物质,按图2所示装置进行实验.当胶头滴管中的液体滴入瓶中,U型管中的液面发生了明显变化.若a处液面降低,可能原因有生成气体,或者物质溶解释放热量,而给定物质溶解放热的情况不存在.而过氧化氢在氧化铁的催化下可以生成氧气,盐酸和碳酸钙反应也能生成气体,所以组合可以为过氧化氢和氧化铁或者是盐酸和碳酸钙.若a处液面升高,是物质溶解吸热或者装置内气体被消耗,可得二氧化碳和氢氧化钙或者水均能满足,对应反应方程式:CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3.
故答案为:
(1)CaCO3;
(2)2CO+O2
2CO2 ;3CO+Fe2O3
2Fe+3CO2;
(3)H2O2或HCl;Fe2O3或CaCO3;和CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3.

(1)Y是大理石的主要成分,为碳酸钙,在碳酸钙中钙元素为+2价,而碳酸根显-2价,根据化合物中化合价的代数和为零,可得其化学式为 CaCO3.
(2)由于N为氧气,而E为一氧化碳E+N→D生成的是二氧化碳,化学方程式 2CO+O2
| ||
| ||
(3)从上述十种物质中任选物质,按图2所示装置进行实验.当胶头滴管中的液体滴入瓶中,U型管中的液面发生了明显变化.若a处液面降低,可能原因有生成气体,或者物质溶解释放热量,而给定物质溶解放热的情况不存在.而过氧化氢在氧化铁的催化下可以生成氧气,盐酸和碳酸钙反应也能生成气体,所以组合可以为过氧化氢和氧化铁或者是盐酸和碳酸钙.若a处液面升高,是物质溶解吸热或者装置内气体被消耗,可得二氧化碳和氢氧化钙或者水均能满足,对应反应方程式:CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3.
故答案为:
(1)CaCO3;
(2)2CO+O2
| ||
| ||
(3)H2O2或HCl;Fe2O3或CaCO3;和CO2+Ca(OH)2=CaCO3↓+H2O或CO2+H2O=H2CO3.
点评:从问题中寻找对应的物质信息用于辅助推断,这是解决问题的更有效的方法,也是最容易对应结果的方法.

练习册系列答案
相关题目
 (2012?浦口区一模)新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,在反应中M的化合价不发生改变.转化流程如图所示,已知MFe2Oy中Fe为+3价.下列说法中,正确的是( )
(2012?浦口区一模)新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,在反应中M的化合价不发生改变.转化流程如图所示,已知MFe2Oy中Fe为+3价.下列说法中,正确的是( )