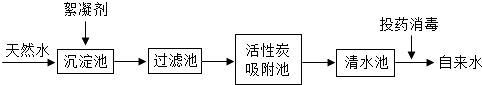
��Ŀ����
����Ŀ��������ͼ1�ش����⣺ 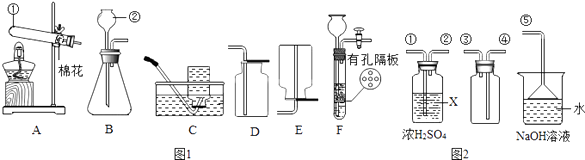
��1��д���б�ŵ��������ƣ��� �� �� ��
��2��ʵ�����ø��������ȡO2�Ļ�ѧ����ʽΪ �� ��A��Dװ����ȡO2ʱ��Ϊ��ֹ������ؽ��뵼�ܣ��ɲ�ȡ�Ĵ�ʩ�� ��
��3��ʵ������B��Cװ����ȡCO2�Ļ�ѧ����ʽΪ �� ��������װ����B��ΪF�����ŵ��� ��
��4��SO2����ɫ�д̼�����ζ���ж����壬�ܶȱȿ�����������ˮ��SO2��ijЩ��ѧ������CO2���ƣ�ʵ���г���NaOH��Һ����SO2β��������ͼ2��ʾװ���ռ�һƿ�����SO2 �� װ���е��ܰ�������������˳���Ǣ١��ڡ������ݣ�����ţ���ͼ��©�������������ձ���NaOH��Һ���������û�ѧ����ʽ��ʾ����
���𰸡�
��1���Թܣ�����©��
��2��2KMnO4 ![]() K2MnO4+MnO2+O2�������Թܿڷ������ɵ�����
K2MnO4+MnO2+O2�������Թܿڷ������ɵ�����
��3��CaCO3+2HCl=CaCl2+H2O+CO2�����濪���ã������ͣ
��4���ܣ��ۣ���ֹSO2����ɢ�ݵ���������Ⱦ����������sO2��NaOH��Һ�ĽӴ������SO2+2NaOH=Na2SO3+H2O
���������⣺��1������ʵ���ҳ�����������ʶ������⣮��Ϊ�����Թܣ��ڳ���©������2��ʵ�����ø�����ؼ��ȣ���������ء��������̡�O2 �� ��ѧ����ʽΪ2KMnO4 ![]() K2MnO4+MnO2+O2����Ϊ��ֹ������ؽ��뵼�ܣ��ɲ�ȡ�Ĵ�ʩ�����Թܿڷ������ɵ����ţ���3��ʵ������B��Cװ����ȡCO2�Ļ�ѧ����ʽΪCaCO3+2HCl=CaCl2+H2O+CO2������������װ����B��ΪF�����ŵ����濪���ã������ͣ�����Կ��Ʒ�Ӧ�ķ�����ֹͣ����4����������Ӧ���ȸ�����ռ����������������������Һ���գ���ֹ��Ⱦ������������ܶȱȿ��������Ӧ�ôӢܽ��۳�������ʱӦ�âٽ��ڳ���������Ũ��������������������ˮ���ŷŵ������л��γ����꣬�����ˮ���գ����Դ��ǣ��ܡ��ۣ�ͼ��©���������Ƿ�ֹSO2����ɢ�ݵ���������Ⱦ����������sO2��NaOH��Һ�ĽӴ�������ձ��ж���������NaOH��Һ��Ӧ�ķ���ʽΪ��SO2+2NaOH=Na2SO3+H2O�� ���Դ��ǣ���1�����Թܣ��ڳ���©������2��2KMnO4
K2MnO4+MnO2+O2����Ϊ��ֹ������ؽ��뵼�ܣ��ɲ�ȡ�Ĵ�ʩ�����Թܿڷ������ɵ����ţ���3��ʵ������B��Cװ����ȡCO2�Ļ�ѧ����ʽΪCaCO3+2HCl=CaCl2+H2O+CO2������������װ����B��ΪF�����ŵ����濪���ã������ͣ�����Կ��Ʒ�Ӧ�ķ�����ֹͣ����4����������Ӧ���ȸ�����ռ����������������������Һ���գ���ֹ��Ⱦ������������ܶȱȿ��������Ӧ�ôӢܽ��۳�������ʱӦ�âٽ��ڳ���������Ũ��������������������ˮ���ŷŵ������л��γ����꣬�����ˮ���գ����Դ��ǣ��ܡ��ۣ�ͼ��©���������Ƿ�ֹSO2����ɢ�ݵ���������Ⱦ����������sO2��NaOH��Һ�ĽӴ�������ձ��ж���������NaOH��Һ��Ӧ�ķ���ʽΪ��SO2+2NaOH=Na2SO3+H2O�� ���Դ��ǣ���1�����Թܣ��ڳ���©������2��2KMnO4 ![]() K2MnO4+MnO2+O2�������Թܿڷ������ɵ����ţ���3��CaCO3+2HCl=CaCl2+H2O+CO2�����濪���ã������ͣ����4���ܡ��ۣ���ֹSO2����ɢ�ݵ���������Ⱦ����������sO2��NaOH��Һ�ĽӴ������SO2+2NaOH=Na2SO3+H2O��
K2MnO4+MnO2+O2�������Թܿڷ������ɵ����ţ���3��CaCO3+2HCl=CaCl2+H2O+CO2�����濪���ã������ͣ����4���ܡ��ۣ���ֹSO2����ɢ�ݵ���������Ⱦ����������sO2��NaOH��Һ�ĽӴ������SO2+2NaOH=Na2SO3+H2O��
�����㾫����������Ҫ��������ȡ�����IJ��������ע������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ�㣬��Ҫ������ȡ�����IJ������裨�Ը��������ȡ����������ˮ���ռ�Ϊ����a�����裺�顪װ�������㡪�ա��ơ�Ϩ��ע�⣺a����ƽ b������ c�����Ų�����ȷ�����⣮

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д� �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�