题目内容
【题目】天然水净化为自来水的主要流程如下: 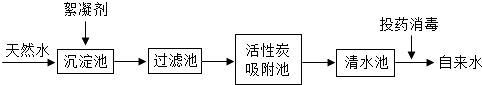
(1)下列说法不正确的是(填字母) .
A.过滤池可以除去难溶性杂质
B.活性炭吸附池可以除去水中的色素和臭味
C.清水池中一定是软水
(2)明矾[KAl(SO4)m12H2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝.m= , 氢氧化铝的化学式为 .
(3)目前不少自来水用液氯(Cl2)作为消毒剂,液氯注入水后发生反应的示意图: 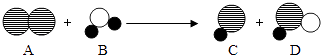
其中“ ![]() ”、“○”、“●”代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
”、“○”、“●”代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
①C物质的水溶液能使紫色的石蕊溶液变成色,取C物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是 , 利用此法可检验自来水中是否含有Cl﹣ .
②液氯与水反应的化学方程式是 .
(4)天然水中微生物使有机物(以C6H10O5表示)转化为CO2和H2O的过程中所需O2的量叫做生化需氧量(BOD,单位为mgL﹣1),反应的化学方程式为:C6H10O5+6O2 ![]() 6CO2+5H20,测得20℃时,某天然水样中含有机物(C6H20O5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
6CO2+5H20,测得20℃时,某天然水样中含有机物(C6H20O5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
【答案】
(1)C
(2)2;Al(OH)3
(3)红;HCl+AgNO3=AgCl↓+HNO3;Cl2+H2O═HCl+HClO
(4)解:设需要氧气的质量为x.
C6H10O5+ | 6O2 |
162 | 192 |
10.8mg | x |
![]() =
= ![]()
x=12.8mg
12.8mg÷1L=12.8mgL﹣
【解析】解:(1)A、过滤适用于不溶于水的固体和液体,可以除去难溶性杂质,故正确; B、活性炭具有吸附性,能够吸附水中的色素和异味,故正确;
C、清水池中不一定是软水,需要用肥皂水检验,泡沫多是软水,泡沫少是硬水,故错误.(2)化合物KAl(SO4)m中,K为+1价、Al为+3价、SO4为﹣2价,根据化合物中各元素的化合价代数和为0,则有(+1)+(+3)+(﹣2)×m=0;
解得:m=2;氢氧化铝的化学式为:Al(OH)3;(3)根据图示可知:改反应的化学方程式为:Cl2+H2O═HCl+HClO,①C物质是氯化氢,水溶液呈酸性,能使紫色的石蕊溶液变成红色;取C物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是HCl+AgNO3=AgCl↓+HNO3 . ②液氯与水反应的化学方程式是Cl2+H2O═HCl+HClO;
【考点精析】认真审题,首先需要了解过滤操作的注意事项(过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损),还要掌握书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号)的相关知识才是答题的关键.