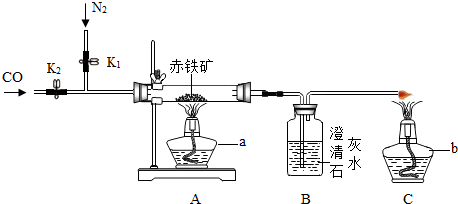
题目内容
实验室用CO还原Fe2O3的方法粗略测定铁的相对原子质量.实验室制取的CO中含有少量的CO2,设计如下装置:
(1)②的作用是______
(2)实验结束时,先关闭K1、K2,再熄灭酒精灯,在冷却过程中可能导致的后果是______
(3)该装置明显有一处错误是______
(4)称量反应前后 ③的质量,进而得到铁的质量为W g,称量反应前后 ④的质量,得到CO2的质量为N g,则铁的相对原子质量=______
(5)经比较实验测定的铁的相对原子质量偏小,其原因可能是______(填字母)
a、装置漏气 b、杂质未被除尽 c、称量准确、d、生成的 CO2有一部分进入澄清石灰水中
(6)将 ①中的 CO 从贮气瓶里排出的操作是,打开K1、K2,向 ①中加入适当的液体,根据下列信息,你选择的一种是______(填字母),不选择其它两种的共同原因______
a、蒸馏水 b、饱和Ca(OH)2 溶液 c、饱和NaOH (溶液20℃时,S Ca(OH)2=0.17g S NaOH=35g.)
(2)分析关闭K1、K2时装置连通的情况,判断停止加热后随装置后压强的变化对装置所产生的影响;
(3)根据CO是有毒气体,使用时要注意其对空气污染,分析装置中存在的缺陷;
(4)根据反应的化学方程式,由反应中铁与二氧化碳的质量关系及实验所得到两物质的质量,计算铁元素的相对原子质量;
(5)分析所提供的四种原因,判断造成测定的铁的相对原子质量偏小的原因;
(6)根据排出CO气体且能完全吸收混在其中二氧化碳气体的要求,判断所应选用的液体.
解答:解:
(1)为防止还原剂CO为纯净干燥的气体,在进行实验前要对气体进行净化与干燥,因此装置②中应放入浓硫酸对CO气体进行干燥;
(2)实验结束时,先关闭K1、K2,再熄灭酒精灯,在冷却过程中CO气体不再通入,装置内气体随降温体积减小,装置内压强减小,与玻璃管相通的氢氧化钠溶液因压强减小而倒吸入玻璃管,可能导致的氢氧化钠溶液会流到玻璃管中,使玻璃管骤冷炸裂;
(3)CO是一种有毒气体,直接排放到空气中会造成空气污染,因此应在装置最后进行尾气的处理,而该装置中却没有处理装置;
(4)设铁元素的相对原子质量为m
3CO+Fe2O3
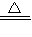 2Fe+3CO2
2Fe+3CO22m 3×44
W N
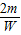 =
= m=
m= (或
(或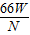 )
)(5)由于铁的相对原子质量为
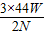 (或
(或 )即使玻璃管内反应后所得固体的质量与氢氧化钠溶液所吸收二氧化碳的质量相关,因此混合气体杂质未被除尽,会使氢氧化钠溶液吸收二氧化碳质量N偏大,而导致实验测定的铁的相对原子质量偏小;装置漏气或生成的 CO2有一部分进入澄清石灰水中,都会使氢氧化钠溶液吸收二氧化碳质量N偏小,导致实验测定的铁的相对原子质量偏大;
)即使玻璃管内反应后所得固体的质量与氢氧化钠溶液所吸收二氧化碳的质量相关,因此混合气体杂质未被除尽,会使氢氧化钠溶液吸收二氧化碳质量N偏大,而导致实验测定的铁的相对原子质量偏小;装置漏气或生成的 CO2有一部分进入澄清石灰水中,都会使氢氧化钠溶液吸收二氧化碳质量N偏小,导致实验测定的铁的相对原子质量偏大;(6)由于蒸馏水或饱和Ca(OH)2 溶液吸收二氧化碳的量较少,可能导致混在CO气体中的二氧化碳气体不能全部吸收,而影响测定结果,故应选用饱和NaOH 溶液.
故答案为:
(1)干燥气体;
(2)导致氢氧化钠溶液会流到玻璃管中,使玻璃管骤冷炸裂;
(3)未进行尾气处理;
(4)
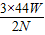 (或
(或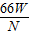 );
);(5)b;
(6)c;吸收的二氧化碳少.
点评:正确理解装置中各个装置的作用,对于正确分析测定结果起到至关重要的作用,体现出实验能力及分析问题的能力.

 名校课堂系列答案
名校课堂系列答案某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
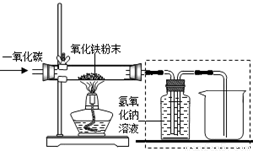
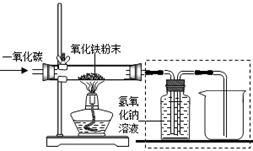
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
|
物质性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
|
颜色 |
黑色 |
黑色 |
红色 |
黑色 |
|
能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。
A.收集CO B.吸收CO2 C.检验CO2
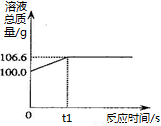
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
 |
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
④
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ▲ 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. ▲ 、c. ▲ 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) ▲ 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 ▲ 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学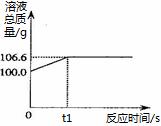 想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 ▲ g;
(7)计算该赤铁矿石中氧化铁的质量分数。 ▲ 。(需要有计算过程)