题目内容
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
【查阅资料】:
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式 。
②NaN3遇盐酸、H2SO4溶液无气体生成; ③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O = NaN3+NaOH+X;则X的化学式为 。
【问题探究】:(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示) ;
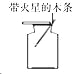
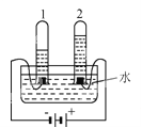
(2)某同学设计如图装置测出碳酸钠的质量分数,其实验数据记录如下:

称量项目 | 称量时间 | 质量(g) |
试样 | 100.00 | |
装置+稀硫酸质量 | 241.20 | |
装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
①写出锥形瓶中发生的反应方程式: ;
②若无浓硫酸的洗气装置,会使测定的结果 (填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为 。
【问题探究】:(二)测定某工业级样品中NaN3的质量分数
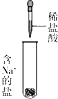
小谈同学精确称量0.140 g NaN3样品,设计如图装置测定其质量分数。

已知2NaN3 → 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(1)检查该装置气密性的方法是:连接好装置,从水准管注水, ,说明气密性良好。
(2)使用冷水冷凝的目的是: 。
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应。 常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A.100 mL B.1 L C.2 L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%)。
【答案】2NaN3 ==2Na+3N2 NH3 (一)(1)2NaOH + CO2 ==== Na2CO3 + H2O; (2)①Na2CO3+H2SO4==2Na2 SO4 +H2O+CO2↑②偏大③5.3%(二)(1)左右两边出现稳定的液面差(2)使水蒸气液化(或除去水蒸气)(3)A(4)92.9%
【解析】
试题分析:①NaN3受撞击会迅速分解生成Na、N2,反应的化学方程式2NaN3 ==2Na+3N2 ;化学方程式中2NaNH2+N2O = NaN3+NaOH+X;则X的化学式的确定根据质量守恒定律反应前后原子的种类和数量不变,可知X的化学式为NH3;(一)(1)根据叠氮钠的工业制法可知,叠氮钠制取的过程中含有氢氧化钠,故含有碳酸钠的原因为2NaOH + CO2 ==== Na2CO3 + H2O;(2)①锥形瓶中发生的反应方程式:Na2CO3+H2SO4==2Na2 SO4 +H2O+CO2↑;②若无浓硫酸的洗气装置,散失到空气中的二氧化碳是潮湿的,因此会使测定的结果偏大;③碳酸钠的质量为x
Na2CO3+ H2SO4==2Na 2SO4+H2O+CO2↑
106 44
X (100+241.2-339.00)
106/44=X/ (100+241.2-339.00)
X=5.3g
碳酸钠的质量分数为5.3g/100g×100%=5.3%
(二)(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好;(2)使用冷水冷凝的目的是使水蒸气液化(或除去水蒸气);(3)根据选择量器近而大的标准可知,选用的量气管规格合适的是100mL,(4)工业级样品中NaN3的质量为X
2NaN3 ==2Na+3N2
130 84
X 67.2/1000×1.25
130/84=X/(67.2/1000×1.25)
X=0.13g
样品中NaN3的质量分数为0.13g/0.14g×100%=92.9%。

【题目】下表中各组物质的鉴别方法正确的是( )
选项 | 需要鉴别的物质 | 鉴别方法 |
A | 稀盐酸、氯化钠溶液、氢氧化钠溶液 | 滴加石蕊溶液 |
B | 硫酸钾、硫酸钡、碳酸钙 | 加入足量的水 |
C | 氮气、氧气、二氧化碳 | 用燃着的木条区分 |
D | 铁粉、木炭粉、氧化铜粉末 | 加入足量的稀硫酸 |
A.A B.B C.C D.D