题目内容
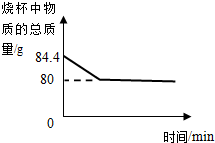 某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量,同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:
某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量,同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:①生成二氧化碳多少克?
②原混合物中碳酸钙的质量分数.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)因为碳酸钙和盐酸反应后会产生二氧化碳气体,所以烧杯中物质总质量会减少,根据质量守恒定律可知,烧杯中物质总质量的减少量就是生成的二氧化碳的质量;
(2)根据化学方程式利用二氧化碳的质量可得到碳酸钙的质量,然后求出碳酸钙的质量分数即可.
(2)根据化学方程式利用二氧化碳的质量可得到碳酸钙的质量,然后求出碳酸钙的质量分数即可.
解答:解:(1)通过图象可知,反应产生的二氧化碳的质量为:84.4g-80g=4.4g
(2)设原混合物中碳酸钙的质量为x,反应后所得溶液中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
=
解得:x=10g
石灰石样品中中碳酸钙的质量分数为:
×100%=62.5%
答:(1)生成二氧化碳的质量为4.4g;
(2)原混合物中碳酸钙的质量分数为62.5%.
(2)设原混合物中碳酸钙的质量为x,反应后所得溶液中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
解得:x=10g
石灰石样品中中碳酸钙的质量分数为:
| 10g |
| 16g |
答:(1)生成二氧化碳的质量为4.4g;
(2)原混合物中碳酸钙的质量分数为62.5%.
点评:此题是和图象相结合的化学方程式的计算题,此题要分析清题意,看懂图象并利用图象中给出的数据来做题,另外要掌握质量分数的公式,难度适中.

练习册系列答案
相关题目
在一个密闭的容器内有四种物质,在一定条件下发生反应,一段时间后测得反应前后各物质的质量如下:
已知:X的相对分子质量为n,Q的相对分子质量为2n,下列推理正确的是( )
| X | Y | Z | Q | |
| 反应前质量/g | 4 | 10 | 1 | 21 |
| 反应后质量/g | 0 | 12 | 15 | 待测 |
| A、反应后Q的质量为8g |
| B、反应生成15gZ |
| C、反应中Y与Q发生改变的质量比为1:1 |
| D、该化学方程式中X和Q的化学计量数之比为2:3 |