题目内容
【题目】(12分)请写出下列反应的化学方程式。
(1)用盐酸除去铁锈: ;
(2)工业上电解水制取氢气: ;
(3)用熟石灰中和工厂废液中的硫酸: ;
(4)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3) : 。
【答案】(1)Fe2O3+6HCl == 2FeCl3+3H2O (2)2H2O通电2H2↑+ O2 ↑
(3)Ca(OH)2 + H2SO4 = CaSO4 + 2H2O (4)3H2 + N2![]() 2NH3
2NH3
【解析】
试题分析:(1)铁锈的主要成分是氧化铁,用盐酸除去铁锈的化学方程式:Fe2O3+6HCl == 2FeCl3+3H2O
(2)工业上电解水制取氢气的化学方程式:2H2O通电2H2↑+ O2 ↑
(3)用熟石灰中和工厂废液中的硫酸的化学方程式:Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
(4)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3) 的化学方程式 :3H2 + N2![]() 2NH3
2NH3

 智能训练练测考系列答案
智能训练练测考系列答案【题目】(18分)实验室处理一批过期的化学药品,兴趣小组同学决定对一癣已经结块的氢氧化钠样品展开探究,请你参与。
[探究活动一]证明变质的样品仍然有氢氧化钠存在
资料摘要:碳酸钠的水溶液呈碱性,氯化钠、氯化钙的水溶液呈中性。
(1)氢氧化钠暴露在空气中发生变质反应的化学方程式为 。
同学们按照如下所示的步骤进行实验:
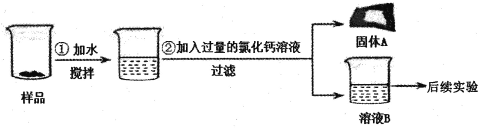
(2)步骤②中加入过量的氯化钙溶液的目的是 ;固体A必定含有的物质是 (写化学式)。
(3)“后续实验”验证氢氧化钠的存在,请你简述实验步骤和产生的现象: 。
[探究活动二]测定样品中碳酸钠的质量分数
取5.3g样品与足量的稀硫酸反应,测量生成二氧化碳的体积,从而计算出碳酸钠的质量分数。实验装置如图(不考虑其他因素的影响,装置的气密性良好):
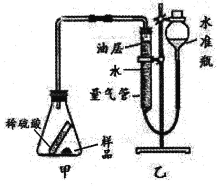
(4)倾斜锥形瓶使样品与稀硫酸充分接触。写出甲装置中发生反应的一个化学方程式: 。
(5)量气管中水面上要加一层植物油(二氧化碳不溶于该油层),目的是 。
(6)实验测得的部分数据如下表所示:
反应前 | 反应后 | |
量气管内液面对应的刻度 | 42mL | 262mL |
根据表中的实验数据计算,反应生成的二氧化碳体积为 mL,已知在实验条件下,二氧化碳的密度为2g·L-1,则生成二氧化碳的质量为 g。
(7)通过计算,样品中碳酸钠的质量分数为 。