题目内容
某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题: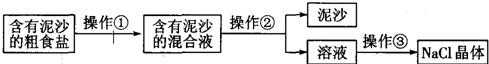
(1)操作①、②、③依次为图中的
(2)在实验室,玻璃棒除了以图示的用途之外,还可用于
(3)为顺利搭建过滤和蒸发装置,应该按照
蒸发时,将氯化钠溶液蒸发至
(4)若NaCl的产率偏低(产率=
| 所得晶体的质量 | 所取样品的质量 |
A.过滤时滤纸有破损 B.称量粗盐时,砝码与粗盐放错托盘
C.溶解含有泥沙的粗盐时,加入的水量不足 D.蒸发时有固体溅出
(5)若要配制100g 10%的氯化钠溶液,下列仪器中,必须用到的玻璃仪器是
a.烧杯 b.10mL量筒 c.100mL量筒 d.滴管 e.玻璃棒 f.药匙 g.蒸发皿
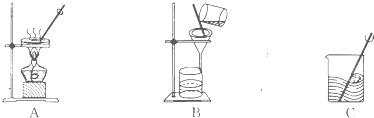
(6)做化学实验要养成良好的整理习惯.若某同学在实验结束后,将仪器按图放置,其中放置正确的一项是

(2)玻璃棒的作用还有转移食盐固体、将滤纸和漏斗内壁压紧、测定溶液pH、取水样蒸发证明是否是纯水等;
(3)为顺利搭建过滤和蒸发装置,应该按照由下而上的顺序进行;
(4)若NaCl的产率偏低,可能原因:蒸发时有固体溅出,溶解含有泥沙的粗食盐时,加入的水量不足.称量粗盐时,砝码与粗盐放错托盘;
(5)熟记要配制NaCl溶液所需仪器;
(6)根据实验室使用药品的注意事项考虑.
故答案为:CBA;
(2)玻璃棒的作用还有:转移食盐固体、测定溶液pH等.
故答案为:转移食盐固体、测定溶液pH等;
(3)为防止酒精灯或下面的烧杯防止不下,搭建过滤和蒸发装置,应该按照由下而上(从低到高)的顺序.若发现滤液浑浊,需要重新过滤.
故答案为:由下而上(从低到高);重新过滤;
(4)若NaCl的产率偏低,可能原因:称量粗盐时,砝码与粗盐放错托盘;溶解含有泥沙的粗盐时,加入的水量不足蒸发时有固体溅出.
故答案为:BCD;
(5)配制时需要的玻璃仪器有烧杯、玻璃棒、滴管、量筒.
故答案为:acde;
(6)酒精灯用完后要盖好灯冒;天平使用完后要把砝码放回砝码盒;试剂瓶在存放时,要盖上瓶盖,防止药品变质;
胶头滴管用过后应立即洗涤干净并插在洁净的试管内;所以其中放置正确的是C.
故答案为:C.

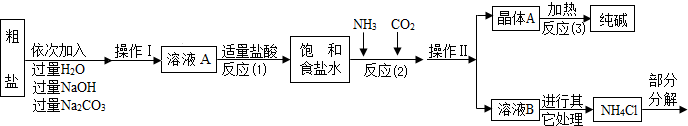
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:
【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式______.
②操作Ⅱ的名称为______.
③反应(1)中加适量盐酸的作用是______.
④反应(2)中为提高产率,所加气体的顺序是______(填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是______(填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为______.
②设计实验检验纯碱样品中是否混有晶体A请完成下表:
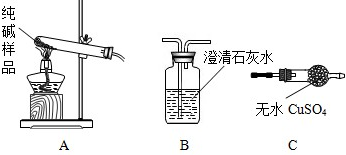
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为______,确定纯碱样品含有杂质NaCl.
【组成探究三】
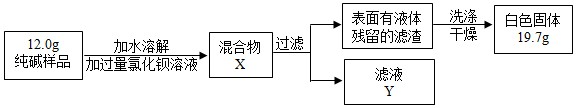
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是______,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加______,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为______ (写出计算过程)
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 ; .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 ; .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
|
|
| 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)