题目内容
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
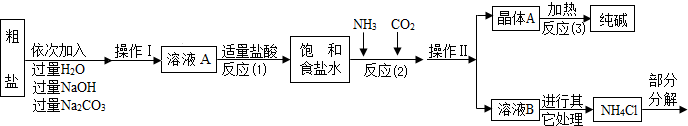
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 ; .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
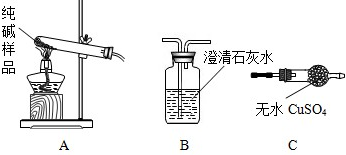
(3)①晶体A受热分解的化学方程式为 ; .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
|
|
| 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
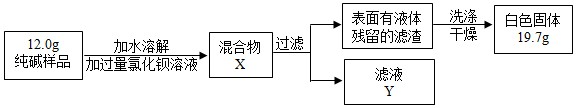
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
| (1)①氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,从而除去氯化镁,可以据此解答该题; ②操作Ⅱ后得到的是晶体和溶液,所以可以判断该操作为过滤; ③加入的氢氧化钠和碳酸钠是过量的,为了得到纯净的氯化钠而加入适量的稀盐酸,可以据此解答该题; ④氨气易溶于水,而二氧化碳的溶解能力比氨气的差,所以应该先通入氨气,再通入二氧化碳,可以据此解答该题; (2)根据反应物与生成物中的共同物质考虑; (3)①根据查阅资料部分可以判断晶体A为碳酸氢钠,碳酸氢钠分解生成了碳酸钠、水和二氧化碳,可以据此解答该题; ②碳酸氢钠受热易分解,所以可以对所得的碳酸钠进行加热,若生成能够使澄清石灰水变浑浊的气体,则可以判断碳酸钠中含有晶体A,即碳酸氢钠; (4)氯化钠与硝酸银反应可生成不溶于硝酸的氯化银沉淀; (5)①根据氯化钡与碳酸钠反应可生成碳酸钡沉淀分析; ②判断滤渣是否洗涤干净,实际上是检验过量的氯化钡溶液是否洗净;然后根据氯化钡可与稀硫酸和碳酸钠溶液反应生成沉淀进行分析解答; ③根据白色固体是碳酸钡,据其质量结合方程式计算碳酸钠的质量,进而计算样品中碳酸钠的质量分数. | |||||||
| 解答: | 解:(1)①氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,从而除去氯化镁,该反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl; ②过滤是把固体与液体分开的操作,操作Ⅱ将混合物分成了晶体与溶液,正是通过过滤操作; ③加入的氢氧化钠和碳酸钠是过量的,为了得到纯净的氯化钠而加入适量的稀盐酸,从而得到较纯净的氯化钠溶液; ④氨气易溶于水,而二氧化碳的溶解能力比氨气的差,所以应该先通入氨气,再通入二氧化碳,故选B; (2)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质,而氢氧化钠得不到重复利用; 故选D; (3)①由题意知:晶体A充分受热,可分解制得纯碱;依据反应流程图可知A是碳酸氢钠,化学反应前后元素的种类不变,从而推测出碳酸氢钠分解生成碳酸钠、水和二氧化碳;该反应的化学方程式为:2NaHCO3 ②碳酸钠化学性质稳定,碳酸氢钠受热易分解生成碳酸钠、水、二氧化碳;而二氧化碳能使澄清的石灰水变浑浊,无水硫酸铜遇水变蓝,可用来检验水,据此可设计实验; (4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,反应掉碳酸钠,再滴加AgNO3溶液,仍有白色沉淀,说明一定含有氯化钠,反应的方程式为AgNO3+NaCl═AgCl↓+NaNO3 (5)①判断加入氯化钡溶液是否过量的合适方法是:静置混合物X,向上层清液中再滴少许氯化钡溶液,如有沉淀生成,说明氯化钡溶液不足;故选A; ②判断滤渣是否洗涤干净,实际上是检验过量的氯化钡溶液是否洗净;氯化钡可与稀硫酸和碳酸钠溶液反应生成硫酸钡和碳酸钡沉淀,通过观察是否有沉淀生成可判断氯化钡溶液是否洗净;故选BC; ③设样品中碳酸钠的质量是X BaCl2+Na2CO3═BaCO3↓+2NaCl 106 197 X 19.7g X=10.6g 所以样品中碳酸钠的质量分数是: 答:样品中碳酸钠的质量分数是88.3%. 故答案为:(1)①2NaOH+MgCl2═Mg(OH)2↓+2NaCl; ②过滤; ③除去过量的氢氧化钠和碳酸钠; ④B; (2)D; (3)①2NaHCO3 ②
(4)AgNO3+NaCl═AgCl↓+NaNO3 (5)①A; ②BC; ③88.3%. |

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:
【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式______.
②操作Ⅱ的名称为______.
③反应(1)中加适量盐酸的作用是______.
④反应(2)中为提高产率,所加气体的顺序是______(填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是______(填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为______.
②设计实验检验纯碱样品中是否混有晶体A请完成下表:
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为______,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是______,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加______,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为______ (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;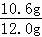 ×100%=88.3%
×100%=88.3%