题目内容
请你用质量守恒定律解释,铁丝燃烧后生成物的质量比铁丝的质量大的原因?
解:因为质量守恒定律适合所有的化学反应,铁丝在氧气中燃烧反应物是铁和氧气,生成的四氧化三铁的质量是铁和与它反应的氧气的质量的和,所以要比铁的质量大.
故答案为:铁丝与氧气反应生成四氧化三铁,根据质量守恒定律,参加反应的铁和氧气质量之和与生成的四氧化三铁质量相等,所以生成物的质量比细铁丝的质量大.
分析:从质量守恒定律的定义来解答.参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,质量守恒定律适合所有的化学反应,有些反应表面上不符合质量守恒,那是忽略了某些气体反应物或生成物的质量.
点评:在应用质量守恒定律时,一定要分清反应物和生成物,不能忽略气体物质的质量.
故答案为:铁丝与氧气反应生成四氧化三铁,根据质量守恒定律,参加反应的铁和氧气质量之和与生成的四氧化三铁质量相等,所以生成物的质量比细铁丝的质量大.
分析:从质量守恒定律的定义来解答.参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,质量守恒定律适合所有的化学反应,有些反应表面上不符合质量守恒,那是忽略了某些气体反应物或生成物的质量.
点评:在应用质量守恒定律时,一定要分清反应物和生成物,不能忽略气体物质的质量.

练习册系列答案
相关题目
质量守恒定律已被无数的实验证实.在用白磷燃烧的实验验证这一定律时,细心的小亮同学发现,老师特别注意在引燃白磷后迅速塞紧锥形瓶的瓶塞.这是为什么?敞口进行实验是什么结果?为探究这一问题,小亮与同学们一起用如图所示的装置进行了对比实验,并得出了结论.
(1)下面是他们进行的两个探究实验报告单,请根据你的分析将下表空白处填写完整.
(2)他们还进行了实验三:燃烧过程和冷却过程容器始终敞口,你对最后称得质量与反应前质量的大小关系的推测是______,你做此推测的理由是______.
(3)下面是小亮和同学们实验后的结论和体会,请你补全.
结论:白磷燃烧的化学反应符合质量守恒定律.
体会:①实验条件控制对于化学实验很重要;②上述对比实验说明,该实验对容器的要求为______.

(1)下面是他们进行的两个探究实验报告单,请根据你的分析将下表空白处填写完整.
| 实验序号 | 实验条件控制 | 最后称得质量与反应前比较 | 解 释 |
| 实验一 | 白磷燃烧时敞口,燃烧完毕盖紧胶塞至冷却 | 偏小 | 生成物______(填化学式)的小颗粒从瓶内逸出 |
| 实验二 | 白磷燃烧时盖紧胶塞,冷却后打开胶塞再称量 | 偏______ | 打开瓶塞后,______进入瓶内 |
(3)下面是小亮和同学们实验后的结论和体会,请你补全.
结论:白磷燃烧的化学反应符合质量守恒定律.
体会:①实验条件控制对于化学实验很重要;②上述对比实验说明,该实验对容器的要求为______.

 质量守恒定律已被无数的实验证实.在用白磷燃烧的实验验证这一定律时,细心的小亮同学发现,老师特别注意在引燃白磷后迅速塞紧锥形瓶的瓶塞.这是为什么?敞口进行实验是什么结果?为探究这一问题,小亮与同学们一起用如图所示的装置进行了对比实验,并得出了结论.
质量守恒定律已被无数的实验证实.在用白磷燃烧的实验验证这一定律时,细心的小亮同学发现,老师特别注意在引燃白磷后迅速塞紧锥形瓶的瓶塞.这是为什么?敞口进行实验是什么结果?为探究这一问题,小亮与同学们一起用如图所示的装置进行了对比实验,并得出了结论.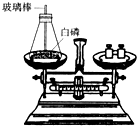 (1)如图所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验.
(1)如图所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验.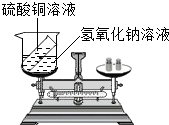 (2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.
(2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.