题目内容
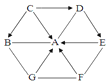
【题目】生活在盐碱湖附近的人们习惯“夏天晒盐(NaCl)、冬天捞碱(Na2CO3)”。Na2CO3和NaCl两物质的溶解度曲线如图所示,据图回答下列问题:
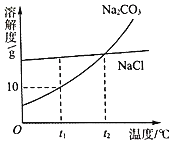
①t1℃时,将15g的Na2CO3加入100g水中可得到______(填“饱和溶液”“不饱和溶液”之一)。
②t2℃时,等质量的Na2CO3和NaCl两种物质的饱和溶液分别降温到t1℃,析出晶体后,此时得到______的溶液质量较大。
③检验“夏天晒盐”所得的NaCl样品中是否混有碳酸钠杂质的方法是______(请从稀盐酸、NaOH溶液、CaCl2溶液中选择一种试剂,并简述操作、现象及结论)
【答案】饱和溶液 NaCl 取适量样品,向其中加入稀盐酸,若有气体生成,则说明样品中混有碳酸钠杂质;反之,则没有。(或取适量样品,向其中加入CaCl2溶液,若有白色沉淀生成,则说明样品中混有碳酸钠杂质)
【解析】
解:①t1℃时,将15g的Na2CO3加入100g水中可得到饱和溶液,因为该温度下碳酸钠的溶解度是10g;故答案为:饱和溶液;
②t2℃时,等质量的Na2CO3和NaCl两种物质的饱和溶液分别降温到t1℃,析出晶体后,此时得到NaCl的溶液质量较大,因为该温度下,氯化钠的溶解度大于碳酸钠的溶解度;故答案为:NaCl;
③检验“夏天晒盐”所得的NaCl样品中是否混有碳酸钠杂质的方法是:取适量样品,向其中加入稀盐酸,若有气体生成,则说明样品中混有碳酸钠杂质;反之,则没有。或取适量样品,向其中加入CaCl2溶液,若有白色沉淀生成,则说明样品中混有碳酸钠杂质;故答案为:取适量样品,向其中加入稀盐酸,若有气体生成,则说明样品中混有碳酸钠杂质;反之,则没有。(或取适量样品,向其中加入CaCl2溶液,若有白色沉淀生成,则说明样品中混有碳酸钠杂质)。

【题目】实验室有一瓶标签腐蚀的溶液A(如图),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。

探究一:A溶液中溶质是什么?
【提出猜想】①CaCl2,②_________________。
【查阅资料】CaCl2溶液呈中性。
【设计实验】同学们设计了如下方案并进行实验。
实验操作 | 实验现象 | 实验结论 |
取少量A溶液于试管中,向其中滴加无色酚酞溶液 | _______________________ | 猜想①正确 |
碳酸钠与其反应的化学方程式为_______________________________________。
探究二:过滤后的滤液中会有哪些溶质?
【提出猜想】小明的猜想:NaCl、CaCl2;
小红的猜想:NaCl;
你的猜想:_________________________。
【设计实验】请设计对“你的猜想”实验:
实验步骤 | 实验现象 | 实验结论 |
_______ | ___________ | 你的猜想正确 |