题目内容
【题目】氧化亚铜(Cu2O)可用于生产船底防污漆,防止海生生物对船舶设备的污损,但其不耐酸 腐蚀。已知 Cu2O + H2SO4 = CuSO4 + Cu + H2O。某兴趣小组将一定质量的氧化亚铜加入盛 有 50 g 质量分数为 9.8%的稀硫酸的烧杯中,恰好完全反应。试计算:
(1)画出氧原子的结构示意图______。
(2)若实验室用 98%的浓硫酸稀释得到上述 50 g 稀硫酸,需要加入水的质量______;
(3)反应后烧杯中溶液溶质的质量分数_____。(计算结果精确到 0.1%)。
【答案】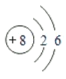 45g 14.8%
45g 14.8%
【解析】
(1)氧原子的核内有8个质子,原子核外有8个电子,其中第一电子层中有2个电子,第二电子层有6个电子,故氧原子的结构示意图画为: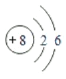 。
。
(2)解:设加入水的质量为x
50g×9.8%=(50gx)×98%
x=45g
答:加入水的质量是45g。
(3)解:参加反应的纯硫酸的质量=50g×9.8%=4.9g
设参加反应的氧化亚铜的质量为a,生成硫酸铜的质量为b,生成铜的质量为c
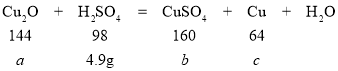
144:98=a:4.9g a=7.2g
98:160=4.9g:b b=8g
98:64=4.9g:c c=3.2g
反应后烧杯中溶液溶质的质量分数=![]() ×100%≈14.8%
×100%≈14.8%
答:反应后烧杯中溶液溶质的质量分数为14.8%。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是________g。
(2)6.5g样品中碳酸钠的质量分数是________。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀硫酸与锥形瓶中溶液的溶质恰好完全反应。
①如图图象中a的数值是________。
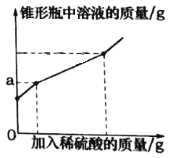
②求该实验中所用稀硫酸的溶质质量分数____。(写出计算过程)