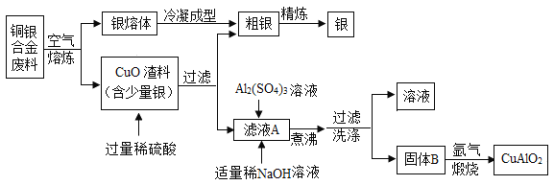
题目内容
【题目】兴趣小组的同学研究(Cu﹣Zn合金)样品中锌的含量,取该样品18g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如图所示.请计算:

(1)18g该样品中锌的质量.
(2)稀硫酸中溶质的质量分数.
【答案】(1)6.5g (2)9.8%
【解析】
试题分析:首先根据图像中的数据可知,反应结束后生成氢气的质量为0.2g,然后根据化学方程式:Zn+ H2SO4 = ZnSO4+ H2↑中H2与Zn、H2SO4的质量关系,可分别计算出Zn、H2SO4的质量,进一步计算稀硫酸中溶质的质量分数
解:设样品中锌的质量为x,硫酸中溶质的质量为y
Zn + H2SO4 = ZnSO4 + H2↑
65 98 2
x y 0.2g
(1)65:2=x:0.2g x=6.5g
(2)98:2=y:0.2g y=9.8g
稀硫酸中溶质的质量分数=9.8g/100g×100%=9.8%
答:(1)18g该样品中锌的质量为6.5g
(2)稀硫酸中溶质的质量分数为9.8%

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目