题目内容
【题目】p型透明导电化合物CuAlO2具有良好的热电性能,在热电转换领域具有广阔的应用前景。银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程。
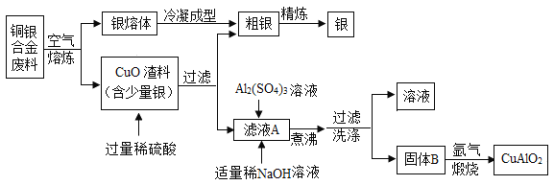
【资料】
Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化。银在空气中不易被氧化。
请回答下列问题:
(1)CuAlO2中铜元素的化合价为______,过滤后所得滤液A中的溶质为__________。
(2)煮沸过程中发生反应的化学方程式为_____________________。
(3)固体B在煅烧时发生的其中一个反应方程式为4CuO + 2Al2O3 ![]() 4CuAlO2+X↑,气体X的化学式为__________。
4CuAlO2+X↑,气体X的化学式为__________。
(4) “煅烧”时温度须控制在1042—1085℃范围内且在氩气中进行,其原因是________。
【答案】 +1 CuSO4、H2SO4 Cu(OH)2![]() CuO+H2O O2 防止温度过高,CuAlO2分解和氧化
CuO+H2O O2 防止温度过高,CuAlO2分解和氧化
【解析】(1)根据化合物中各元素化合价的代数和为0,可设CuAlO2中铜元素的化合价为x,x+(+3)+(-2)×2=0,解得:x=+1;由于银不与硫酸反应,氧化铜和硫酸反应生成硫酸铜和水,硫酸过量,所以过滤后所得滤液A中的溶质为CuSO4、H2SO4;
(2)滤液A中硫酸铜与氢氧化钠反应生成氢氧化铜,煮沸过程中氢氧化铜分解为氧化铜和水,发生反应的化学方程式为Cu(OH)2![]() CuO+H2O;
CuO+H2O;
![]() (3)根据质量守恒,可知反应前后原子的种类和数目都不变,4CuO + 2Al2O3 4CuAlO2+X↑,反应前有Cu-4个,O-10个, Al-4个,反应后Cu-4个,O-8个, Al-4个,所以X为O2;
(3)根据质量守恒,可知反应前后原子的种类和数目都不变,4CuO + 2Al2O3 4CuAlO2+X↑,反应前有Cu-4个,O-10个, Al-4个,反应后Cu-4个,O-8个, Al-4个,所以X为O2;
(4)由于“CuAlO2高温易分解、受热易氧化”,所以控制在1042—1085℃范围内且在氩气中进行防止温度过高,CuAlO2分解和氧化。


