题目内容
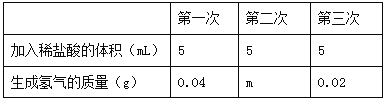
【题目】我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
试求:此黄铜样品中锌的质量分数是多少?(写出计算过程,结果保留至0.1%)
【答案】65.0%
【解析】本题考查了根据化学方程式计算。
根据表格可以发现,第一次加入5mL盐酸生成0.04g氢气,第三次加入5mL盐酸还能生成并且只生成0.02g氢气,说明直到第三次反应才结束,并且盐酸有剩余(按照比例,正好剩余一半);同时说明第二次加入5mL盐酸时完全反应,生成氢气的质量可按照第一次的数量关系(5ml对应0.04g)类推,而得出m为0.04g,共生成氢气的质量为0.1g。
设:生成氢气0.1g需要锌的质量为x,则有
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g
![]()
x=3.25g
所以此黄铜样品中锌的质量分数为: ![]() ×100%=65%.
×100%=65%.

练习册系列答案
相关题目