题目内容
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。
查阅资料①Na2CO3 + CaCO3 = CaCO3↓+ 2NaCl
①2NaHCO3![]() Na2CO3 +CO2↑+ H2O
Na2CO3 +CO2↑+ H2O
③Ca(HCO3)2易溶于水。
④CaCl2 溶液分别与NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数)
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1%来源:学#科#网Z#X#X#K] | 无明显现象 | 有浑浊 | 有浑浊 源:Z§X§X§K] | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
【进行实验】
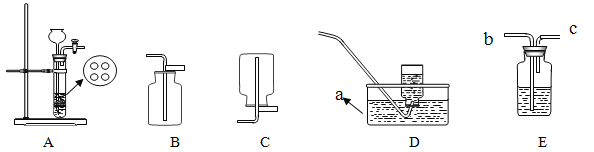
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验 1 |
| 向2支试管中分别加入少量Na2CO3 和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
实验 2 |
| 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量Na2CO3或 NaHCO3固体,分别加热一 段时间 | Na2CO3受热时Ⅱ中无明 显现象 NaHCO3受热时Ⅱ中出现 浑浊 |
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量 5%的NaHCO3溶液,再滴加5%的 CaCl2溶液 | Ⅰ中出现浑浊,有气泡产生Ⅱ中出现浑浊 |
【解释与结论】
(1)实验 1 中,NaHCO3与盐酸反应的化学方程式为 。
(2)实验 2 中,试剂 a 为 。
(3)实验 3 中,NaHCO3与CaCl2反应的化学方程式为:
2NaHCO3 + CaCl2 = ______+______+______+H2O
[反思与评价](1)实验 2 中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为 (写出所有可能)。
(2)资料④中,NaHCO3 溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是______________。
(3)用两种不同的方法鉴别碳酸钠和碳酸氢钠固体,实验方案分别为:
① ;②
【答案】(1) NaHCO3 + HCl = NaCl +H2O + CO2 ↑(2)Ca(OH)2 溶液
(3)2NaHCO3 + CaCl2= CaCO3↓+2NaCl + CO2 ↑+ H2O
【反思与评价】(1)Na2CO3;Na2CO3,NaHCO3
(2)CaCl2 溶液的溶质质量分数较小,生成的 CO2 量较少,CO2 溶于水,因此没有气泡
(3)①各取少量 0.1% 的NaHCO3和 Na2CO3加入等质量的 5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3②各取少量Na2CO3和 NaHCO3固体于实验 2 装置中,若观察到澄清石灰水变浑浊,固体为 NaHCO3,若观察到无明显现象,固体为Na2CO3(其他合理答案均给分)
【解析】
试题分析:(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;(2)即用于检测二氧化碳的澄清石灰水;(3)由现象可知生成了碳酸钙沉淀和二氧化碳气体,因此可得方程式;
【反思与评价】(1)若完全反应,那么残余物为碳酸钠;若部分反应,那么残余物为碳酸钠和碳酸氢钠;
(2)只有浑浊时CaCl2溶液的溶质质量分数为0.1%较小,生成的CO2量较少,CO2溶于水,因此没有气泡
(3)①各取少量 0.1% 的NaHCO3和Na2CO3加入等质量的 5%的 CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3②各取少量Na2CO3和NaHCO3固体于实验 2 装置中,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3(其他合理答案均给分)

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案