题目内容
【题目】根据下列实验装置图,回答有关问题。

(1)写出有关标号仪器的名称a
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是 ,该反应的化学方程式是 。实验室制取二氧化碳的化学方程式是 ,若要获得干燥的二氧化碳除发生装置外,还应选用C装置,并在该装置中盛放 (填试剂的名称)。如果用D装置收集二氧化碳气体,则气体从 (填“b”或“c”)端进入。
(3)工业上以氨气为原料制备硝酸(HNO3)的过程(见图1),

①完成图1工业上用氨气制取NO的化学方程式:4NH3 + 5O2 ═ 4NO+ 6 。然后产生的NO被氧气氧化成NO2,NO2和水反应再生成硝酸和NO。
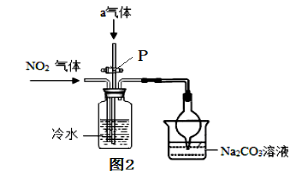
②某课外小组认真分析了工业制取硝酸的流程及反应原理,设计了如图2的实验装置来制备硝酸。试回答:
连接好图2装置后,首先进行的操作是检查装置的气密性,具体的操作方法是 。若图2中通入的气体a是氧气, 则Na2CO3溶液的作用主要是吸收二氧化氮等,以防止 。
【答案】(1)长颈漏斗
(2)A,2KMnO4 △K2MnO4 +MnO2 + O2↑;CaCO3+2HCl==CaCl2+H2O+CO2↑ 浓硫酸 b(3)①H2O②防止污染空气。
【解析】
(1) 试题分析:(2)根据反应物的状态和反应条件选择发生装置,用加入高锰酸钾制取氧气属固固加热型,选A装置;加热高锰酸钾分解制取氧气的同时,还生成了锰酸钾和二氧化锰,故反应的化学方程式是2KMnO4 △K2MnO4 +MnO2 + O2↑;实验室用法石灰石和稀盐酸反应制取二氧化碳,同时还生成了氯化钙和水:CaCO3+2HCl==CaCl2+H2O+CO2↑;要得到干燥的二氧化碳,那么要对二氧化碳进行干燥,一般用浓硫酸做干燥剂,故D装置中盛放的是浓硫酸;二氧化碳的密度比空气大,会先聚集在集气瓶的底部,故二氧化碳应从b端通入;
(3)①根据质量守恒定律化学反应前后原子的种类和数目不变,故生成的是一氧化氮和水;②检查该装置气密性的方法是:用止水夹夹住进气口和出气口后,从上面的导气管通入气体,若进气口的导管会形成一段水柱,说明装置的气密性良好;二氧化氮属空气污染物,故Na2CO3溶液的作用主要是吸收二氧化氮,防止污染空气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题
ⅠA | 0 | |||||||
第一周期 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
第二周期 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
第三周期 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar氩 39.95 |
(1)元素周期表中位于第三周期、第IIIA族的元素是________(填名词),该元素的原子在化学反应中容易_______(填“得”或“失”)
(2)不同种元素最本质的区别是__________。
A.质子数不同 B.最外层电子数不同
C.中子数不同 D.相对原子质量不同
(3)右图为某粒子结构示意图,当x﹣y=8时,该粒子符号为____________。

【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。
查阅资料①Na2CO3 + CaCO3 = CaCO3↓+ 2NaCl
①2NaHCO3![]() Na2CO3 +CO2↑+ H2O
Na2CO3 +CO2↑+ H2O
③Ca(HCO3)2易溶于水。
④CaCl2 溶液分别与NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数)
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1%来源:学#科#网Z#X#X#K] | 无明显现象 | 有浑浊 | 有浑浊 源:Z§X§X§K] | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
【进行实验】
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验 1 |
| 向2支试管中分别加入少量Na2CO3 和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
实验 2 |
| 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量Na2CO3或 NaHCO3固体,分别加热一 段时间 | Na2CO3受热时Ⅱ中无明 显现象 NaHCO3受热时Ⅱ中出现 浑浊 |
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量 5%的NaHCO3溶液,再滴加5%的 CaCl2溶液 | Ⅰ中出现浑浊,有气泡产生Ⅱ中出现浑浊 |
【解释与结论】
(1)实验 1 中,NaHCO3与盐酸反应的化学方程式为 。
(2)实验 2 中,试剂 a 为 。
(3)实验 3 中,NaHCO3与CaCl2反应的化学方程式为:
2NaHCO3 + CaCl2 = ______+______+______+H2O
[反思与评价](1)实验 2 中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为 (写出所有可能)。
(2)资料④中,NaHCO3 溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是______________。
(3)用两种不同的方法鉴别碳酸钠和碳酸氢钠固体,实验方案分别为:
① ;②


