题目内容
【题目】K2CO3和KNO3在不同温度时的溶解度数据及对应的溶解度曲线如下:
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度 (g/100g水) | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
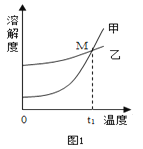
①图1中表示KNO3溶解度曲线的是(24)(填“甲”或“乙”);
②曲线上M点的含义是 (25) ;
③图1中t1的温度范围为 (26) ;
④20℃时,60g K2CO3固体加入到50克水中,得到的溶液的溶质质量分数是(27) ;
⑤80℃ 时有KNO3饱和溶液(含少量K2CO3),若要得到较纯净的KNO3晶体,宜采用实验操作方法是 (28) ;
⑥40℃ 时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃ ,其结果如图2所示。有关说法中,正确的有 (29) 。(填字母)
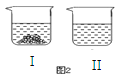
A.烧杯Ⅱ中溶液是不饱和溶液
B.烧杯Ⅰ中溶解的是KNO3,烧杯Ⅱ中溶解的是K2CO3
C.升高温度或增加溶剂都有可能将烧杯Ⅰ中固体全部溶解
D.若将烧杯Ⅰ中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
【答案】(24) 甲 (25) t1时K2CO3、KNO3的溶解度相等 (26) 60℃-80℃
(27)52.4% (28) 降温结晶(或冷却热的饱和溶液) (29)BC
【解析】
试题分析:①根据表格中的数据,可知硝酸钾的溶解度随温度的升高而增大且受温度影响很大,则甲表示硝酸钾的溶解度曲线。②曲线上的M点t1时,甲和乙的溶解度相等。③图1中t1的温度范围为60℃-80℃; ④20℃时,100克水中最多能溶解110克的碳酸钾,20℃时,50克水中最多能溶解碳酸钾的质量为55克,此时溶液中溶质质量分数=55g/(55g+50g)*100%=52.4%;⑤根据溶解度曲线知,硝酸钾的溶解度受温度影响变化较大,而碳酸钾受温度影响变化较小,80℃ 时有KNO3饱和溶液(含少量K2CO3),若要得到较纯净的KNO3晶体,应该采用降温结晶的方法。⑥A、烧杯Ⅱ中溶液可能是不饱和溶液,也可能是饱和溶液,错误;B、40℃ 时,碳酸钾的溶解度大于硝酸钾的溶解度,则烧杯Ⅰ中溶解的是KNO3,烧杯Ⅱ中溶解的是K2CO3,正确;C、烧杯Ⅰ中有固体剩余,则此时的溶液使饱和溶液,要将固体全部溶解可以采用升高温度或增加溶剂的方法,正确;D、若将烧杯Ⅰ中的溶液变为不饱和溶液,若采用升高温度的方法,此时溶液中溶质质量分数不变;若采用增加溶剂的方法,则溶液中溶质质量分数一定减小。故选BC