题目内容
下列是初中化学部分重要的实验.请按要求填空:

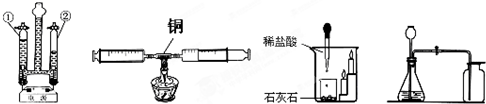
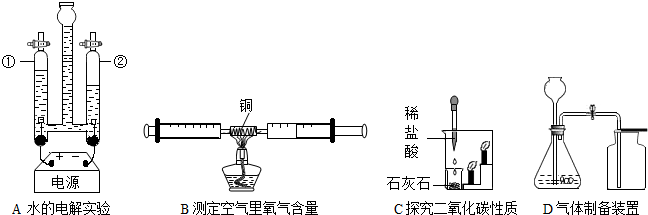
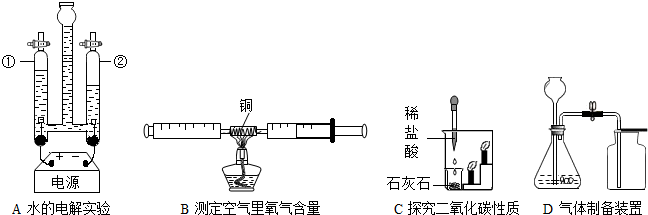
(1)装置A的实验能说明CO2具有的性质是
(2)①装置B中利用的反应原理是
②实际上用电解水的方法制氢气成本很高.据报道,科学家研制出了一种氮化镓-锑合金,利用它能更好地促进水在太阳光下分解获得氢气,且可重复使用.图是水分解为氢气和氧气过程中出现的微粒示意图,请按它们在化学变化过程中出现的顺序排列
③氮化镓-锑合金在利用太阳光分解水的反应中起

(1)装置A的实验能说明CO2具有的性质是
不能燃烧也不支持燃烧,密度比空气大
不能燃烧也不支持燃烧,密度比空气大
(2)①装置B中利用的反应原理是
2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
(填化学方程式);
| ||
②实际上用电解水的方法制氢气成本很高.据报道,科学家研制出了一种氮化镓-锑合金,利用它能更好地促进水在太阳光下分解获得氢气,且可重复使用.图是水分解为氢气和氧气过程中出现的微粒示意图,请按它们在化学变化过程中出现的顺序排列
丙
丙
→甲
甲
→乙
乙
.(用“甲”、“乙”、“丙”表示)③氮化镓-锑合金在利用太阳光分解水的反应中起
催化
催化
作用.分析:(1)要从蜡烛熄灭和从下往上熄灭来分析出二氧化碳的性质再考虑得出的结论;
(2)①根据电解水的反应原理分析;②根据化学反应的实质进行分析;③根据催化剂的概念进行分析.
(2)①根据电解水的反应原理分析;②根据化学反应的实质进行分析;③根据催化剂的概念进行分析.
解答:解:(1)由两根蜡烛都熄灭可知二氧化碳既不能燃烧也不支持燃烧,由两根蜡烛是由下而上熄灭说明二氧化碳先聚集在下边,所以二氧化碳密度比空气大,故答案为:不能燃烧也不支持燃烧,密度比空气大;
(2)①电解水实验的反应原理是2H2O
2H2↑+O2↑;
②由化学反应的实质可知:化学反应的过程就是参加反应的各物质的原子,重新组合生成其他物质的过程,所以水分解生成氢气和氧气的过程就是水分子分解为氢原子和氧原子,每两个氢原子构成以一个氢分子,每两个氧原子构成一个氧分子,在图中化学变化过程中出现的顺序排列丙、甲、乙;
③催化剂能改变化学反应的速率,而本身的质量和化学性质不变.由题意可知:氮化镓-锑合金,能更好地促进水在太阳光下分解获得氢气,且可重复使用,符合催化剂的特点,所以氮化镓-锑合金在利用太阳光分解水的反应中起催化作用.
故答为:①2H2O
2H2↑+O2↑;②丙;甲;乙;③催化.
(2)①电解水实验的反应原理是2H2O
| ||
②由化学反应的实质可知:化学反应的过程就是参加反应的各物质的原子,重新组合生成其他物质的过程,所以水分解生成氢气和氧气的过程就是水分子分解为氢原子和氧原子,每两个氢原子构成以一个氢分子,每两个氧原子构成一个氧分子,在图中化学变化过程中出现的顺序排列丙、甲、乙;
③催化剂能改变化学反应的速率,而本身的质量和化学性质不变.由题意可知:氮化镓-锑合金,能更好地促进水在太阳光下分解获得氢气,且可重复使用,符合催化剂的特点,所以氮化镓-锑合金在利用太阳光分解水的反应中起催化作用.
故答为:①2H2O
| ||
点评:准确理解催化剂的“一边二不变”的特点,会判断在一些反应中,某些物质是否催化剂.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目