题目内容
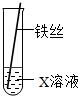 如图所示,将铁丝插入试管中,一段时间后取出铁丝,洗净、干燥、称量,铁丝的质量增加,则试管中所装的溶液是
如图所示,将铁丝插入试管中,一段时间后取出铁丝,洗净、干燥、称量,铁丝的质量增加,则试管中所装的溶液是A、稀硫酸 B、硫酸铜溶液 C、硫酸锌溶液 D、
考点:金属的化学性质
专题:金属与金属材料
分析:据物质间的反应进行分析,金属与酸反应金属溶于酸而使溶液质量增加,金属与盐溶液反应溶液质量的变化取决于参加反应的金属的质量和反应后置换出的金属的质量,若参加反应的金属的质量大于生成的金属或气体的质量,则溶液质量增加,金属丝的质量减少,若参加反应的金属的质量小于生成的金属的质量,则溶液质量减少,金属丝的质量增加.
解答:解:A、铁与稀硫酸能反应,生成氢气和硫酸亚铁而使溶液质量增加,其原因是:由反应的化学方程式:Fe+H2SO4═FeSO4+H2↑,可知56gFe反应溶液增加(56-2)=54g,溶液质量增加,但是金属铁因为溶解而质量减小,故A错误;
B、铁的金属活动性比铜强,所以铁与硫酸铜反应生成硫酸亚铁和Cu,
Fe+CuSO4═FeSO4+Cu
56 64
参加反应的铁的质量小于生成的铜的质量,所以铁质量增大,溶液质量减轻,故B正确;
C、铁与硫酸锌接触时,由于铁的活动性比锌弱,所以两者不会反应,铁的质量不会变化,故C错误;
D、铁可以和硝酸银溶液反应,生成银和硝酸亚铁,铁的相对原子质量小于银的相对原子质量,所以反应后,溶液质量减少,铁丝质量增加.
故选B.补充D为:硝酸银溶液.
B、铁的金属活动性比铜强,所以铁与硫酸铜反应生成硫酸亚铁和Cu,
Fe+CuSO4═FeSO4+Cu
56 64
参加反应的铁的质量小于生成的铜的质量,所以铁质量增大,溶液质量减轻,故B正确;
C、铁与硫酸锌接触时,由于铁的活动性比锌弱,所以两者不会反应,铁的质量不会变化,故C错误;
D、铁可以和硝酸银溶液反应,生成银和硝酸亚铁,铁的相对原子质量小于银的相对原子质量,所以反应后,溶液质量减少,铁丝质量增加.
故选B.补充D为:硝酸银溶液.
点评:本题考查了金属与酸或盐反应时溶液质量的变化,完成此题,可以依据物质间反应的化学方程式进行计算,注意固体质量差量法的应用.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目
下列实验现象的描述,正确的是( )
| A、把燃着的木条伸入呼出的气体中,木条燃烧情况没有明显变化 |
| B、硫在空气中燃烧,发出明亮的蓝紫色火焰 |
| C、木炭在氧气中燃烧比在空气中燃烧更旺,发出白光,并放出热量 |
| D、黄铜和纯铜片相互刻划后,黄铜表面会出现深深的划痕 |
下列鉴别物质的方法不能达到目的是( )
| A、用带火星的木条鉴别:O2和CO2 |
| B、用闻气味的方法鉴别N2和O2 |
| C、用观察法鉴别:氯化钠溶液和氯化铜溶液 |
| D、用水鉴别:Na2CO3粉末和CaCO3粉末 |
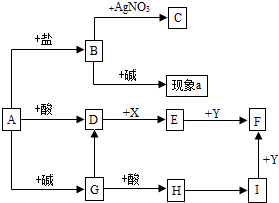 如图是初中化学常见的化学物质间的转化关系.(反应条件与部分产物已略去),其中C为既不溶于水也不溶于酸的白色沉淀,D、E、I均为气体,X为黑色固体,Y为红色固体,请回答下列问题:
如图是初中化学常见的化学物质间的转化关系.(反应条件与部分产物已略去),其中C为既不溶于水也不溶于酸的白色沉淀,D、E、I均为气体,X为黑色固体,Y为红色固体,请回答下列问题: