题目内容
在密闭容器中,将少量乙醇置于一定量的氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
根据质量守恒定律,得出表中x的值为 ;参加反应的乙醇和氧气的分子个数之比是 ;W中含有的元素是 (填元素名称).
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g | 48 | 80 | 0 | 0 | O |
| 反应后质量/g | 2 | 0 | 44 | 54 | x |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:由题意“在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W”,则可知反应物为乙醇(化学式C2H5OH)和氧气,生成物为二氧化碳、水蒸气和W.根据质量守恒定律中的元素守恒,通过计算参加反应的乙醇中的氧元素与氧气、二氧化碳与水中氧元素的质量;计算乙醇、水中的氢元素的质量;可知x的值.
解答:解:因为反应物为乙醇和氧气,质量共46g+80g=126g,根据质量守恒定律可知,生成物的质量应为126克,所以x的值为:126g-44g-54g=28g;
参加反应的乙醇和氧气的分子个数之比是
:
=2:5;
由题目中的表格可知,参加反应的乙醇为48g-2g=46g,它含有的氢元素的质量为:46g×
×100%=6g,而生成物54克水中氢元素的质量为:54g×
×100%=6g,则W物质一定没有氢元素;同理,根据质量守恒定律中的元素守恒,通过计算参加反应的乙醇中的氧元素与氧气中氧元素的质量共为96克,它应等于生成物中氧元素的质量之和,而通过计算二氧化碳与水中的氧元素的质量之和为80,所以W物质一定含有氧元素.
故填:28;2:5;碳元素和氧元素.
参加反应的乙醇和氧气的分子个数之比是
| 48g-2g |
| 12×2+1×5+16+1 |
| 80g |
| 16×2 |
由题目中的表格可知,参加反应的乙醇为48g-2g=46g,它含有的氢元素的质量为:46g×
| 6 |
| 46 |
| 2 |
| 18 |
故填:28;2:5;碳元素和氧元素.
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列说法不正确的是( )
| A、氯酸钾制取氧气是分解反应 |
| B、铁在氧气中燃烧既是氧化反应,又是化合反应 |
| C、蜡烛在空气中燃烧是氧化反应不是化合反应 |
| D、若某反应是化合反应则一定是氧化反应 |


 ”和“
”和“ ”分别表示两种质子数不同的原子,a、b分别表示反应前和反应后的物质.请回答:
”分别表示两种质子数不同的原子,a、b分别表示反应前和反应后的物质.请回答:
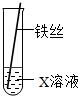 如图所示,将铁丝插入试管中,一段时间后取出铁丝,洗净、干燥、称量,铁丝的质量增加,则试管中所装的溶液是
如图所示,将铁丝插入试管中,一段时间后取出铁丝,洗净、干燥、称量,铁丝的质量增加,则试管中所装的溶液是