题目内容
(2008?上海)某工厂每天产生浓度为0.49%的废H2SO4溶液1×106g,需要用碱溶液中和处理.试计算:(1)该厂每天要处理的废酸液中含有H2SO4______g,是______mol H2SO4.
(2)若用烧碱处理废酸液,每天需要NaOH______mol.
(3)若改用熟石灰处理废酸液,则每天需要Ca(OH)2的物质的量______NaOH的物质的量(填“大于”、“小于”或“等于”).
【答案】分析:(1)利用溶质质量=溶液质量×溶液的溶质质量分数,计算每天要处理的废酸中硫酸的质量;再使用n=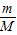 求得硫酸的物质的量;
求得硫酸的物质的量;
(2)根据反应的化学方程式,判断氢氧化钠与硫酸反应时两物质的物质的量的比,然后根据硫酸的物质的量计算需要氢氧化钠的物质的量;
(3)根据反应的化学方程式,判断使用氢氧化钙时氢氧化钙与硫酸的物质的量的比,与使用氢氧化钠反应时进行对比,判断每天需要两种碱物质的量的大小关系.
解答:解:(1)每天要处理的废酸液中含有H2SO4的质量=1×106g×0.49%=4900g;
每天的处理废水中H2SO4的物质的量=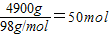 ;
;
故答案为:4900;50;
(2)根据反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O,可知NaOH与H2SO4反应的物质的量之比为2:1,
则需要NaOH物质的量=2×50mol=100mol;
故答案为:100;
(3)根据Ca(OH)2+H2SO4=CaSO4+2H2O,可知Ca(OH)2与H2SO4反应的物质的量之比为1:1,小于NaOH与H2SO4反应的物质的量之比(2:1),则每天需要Ca(OH)2的物质的量小于NaOH的物质的量.
故答案为:小于.
点评:利用反应的化学方程式可以表示反应中各物质的量的关系,可根据一种物质的量而求得反应中其它物质的量.
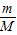 求得硫酸的物质的量;
求得硫酸的物质的量;(2)根据反应的化学方程式,判断氢氧化钠与硫酸反应时两物质的物质的量的比,然后根据硫酸的物质的量计算需要氢氧化钠的物质的量;
(3)根据反应的化学方程式,判断使用氢氧化钙时氢氧化钙与硫酸的物质的量的比,与使用氢氧化钠反应时进行对比,判断每天需要两种碱物质的量的大小关系.
解答:解:(1)每天要处理的废酸液中含有H2SO4的质量=1×106g×0.49%=4900g;
每天的处理废水中H2SO4的物质的量=
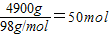 ;
;故答案为:4900;50;
(2)根据反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O,可知NaOH与H2SO4反应的物质的量之比为2:1,
则需要NaOH物质的量=2×50mol=100mol;
故答案为:100;
(3)根据Ca(OH)2+H2SO4=CaSO4+2H2O,可知Ca(OH)2与H2SO4反应的物质的量之比为1:1,小于NaOH与H2SO4反应的物质的量之比(2:1),则每天需要Ca(OH)2的物质的量小于NaOH的物质的量.
故答案为:小于.
点评:利用反应的化学方程式可以表示反应中各物质的量的关系,可根据一种物质的量而求得反应中其它物质的量.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
(2008?上海)某同学在自主学习酸的知识时,设计了以下实验报告,请将实验报告补充完整.
(实验目的)______
(实验用品)试管、铁片、铜片、稀盐酸、稀硫酸、NaOH溶液、石蕊和酚酞试液等
(实验内容)
(实验思考)从物质组成的角度解释稀酸具有酸的通性的原因______.
(实验目的)______
(实验用品)试管、铁片、铜片、稀盐酸、稀硫酸、NaOH溶液、石蕊和酚酞试液等
(实验内容)
| 实验步骤 |  |  |  |
| 实验现象 | 溶液变为______色 | 稀酸中的铁片表面都有______产生; 铜片表面都没有明显现象 | 溶液由红色变为无色 |
| 分析与结论 | 结论: 稀酸能与指示剂作用 | 铁与稀硫酸反应的化学方程式为______ 结论:稀酸能与较活泼金属反应 | 结论: 酸能______ |