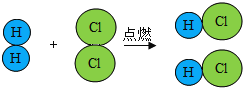
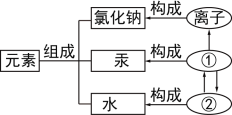
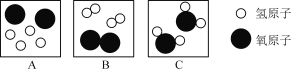
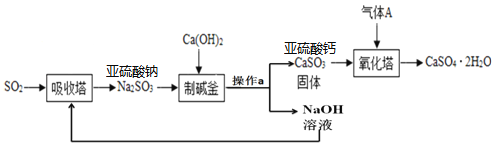
题目内容
【题目】测定空气中氧气的含量,也可用如下方案:选用实际容积为40 mL的试管作反应容器,将过得的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如图的实验装置。假设此实验能够正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:

(1)实验前,要先检查气密性,其方法是:打开弹簧夹,将注射器活塞前沿从20 mL刻度处推至15 mL刻度处,____________,则说明装置的气密性好。
(2)实验中,若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到活塞前沿将在__________刻度处;若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。除观察到白磷燃烧现象外,还可观察到___________。
(3)写出红磷燃烧的化学方程式____________。
【答案】若活塞仍能返回至20mL刻度 12mL 活塞先向右移动,最终稳定在约8mL的刻度线上 4P + 5O2![]() 2P2O5
2P2O5
【解析】
根据检测装置气密性原理,红磷测定空气组成的实验原理,进行分析解答。在(2)题中,注意被消耗的氧气是试管内的还是试管和注射器内的空气。
(1)打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明整个装置都不漏气;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,这时白磷燃烧消耗掉的只是试管内的氧气,40mL×![]() =8mL,活塞应停在20mL﹣8mL=12mL的刻度处;若不使用弹簧夹,用酒精灯加热白磷,白磷实际消耗掉的是试管40mL和注射器内20mL的氧气为(40mL+20mL)×
=8mL,活塞应停在20mL﹣8mL=12mL的刻度处;若不使用弹簧夹,用酒精灯加热白磷,白磷实际消耗掉的是试管40mL和注射器内20mL的氧气为(40mL+20mL)×![]() =12mL,活塞应停在20mL﹣12mL=8mL的刻度处。白磷燃烧放出热量,装置内的气体受热膨胀,气压增大,活塞先向右移动,冷却后装置内的气压降低,活塞先向左移动最终稳定在约8mL的刻度线上;
=12mL,活塞应停在20mL﹣12mL=8mL的刻度处。白磷燃烧放出热量,装置内的气体受热膨胀,气压增大,活塞先向右移动,冷却后装置内的气压降低,活塞先向左移动最终稳定在约8mL的刻度线上;
(3)磷燃烧是与氧气发生反应生成了五氧化二磷,反应的化学方程式是4P + 5O2![]() 2P2O5。
2P2O5。