题目内容
某工厂需要280g生石灰(CaO)作干燥剂,需要碳酸钙的质量是多少?至少需要含碳酸钙80%的石灰石(杂质不参加反应)的质量是多少?(CaCO3 CaO+CO2↑)
CaO+CO2↑)
625g
解析试题分析:设用去的碳酸钙的质量为x,
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
x 280g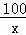 =
=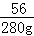
解得:x=500g
所以需要石灰石的质量为:500g÷80%=625g
答:需要碳酸钙的质量是500g;至少需要含碳酸钙80%的石灰石的质量是625g.
考点:根据化学反应方程式的计算.
点评:本题考查学生利用化学反应方程式的计算,学生应明确纯物质的纯质量才能代入化学反应方程式来计算,并注意计算格式的规范和清晰的解答思路.

练习册系列答案
相关题目
已知某CO和02的混合气体中,碳元素、氧元素的质量比为1:4,现取12g该混合气体在密闭容器中点燃,充分反应后,生成二氧化碳的质量为
| A.3.8g | B.8.8g | C.12g | D.13.2g. |
将80 g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
| A.80 g | B.100 g | C.200 g | D.280 g |
 2Fe+Al2O3若建设中需要56kg的铁,则消耗铝粉的质量是多少?
2Fe+Al2O3若建设中需要56kg的铁,则消耗铝粉的质量是多少?