题目内容
【题目】金属用途广泛,其结构和性质等是化学的重要研究内容。
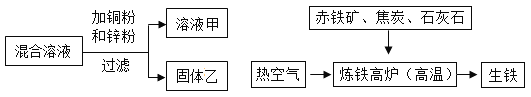
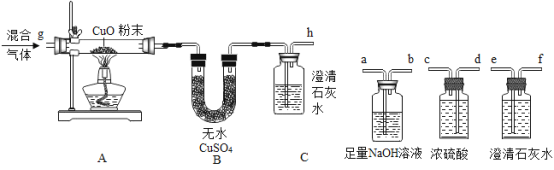
(1)某化学小组用一定量AgNO3和Al(NO3)3混合溶液进行了如图实验,已知溶液甲呈蓝色,向固体乙上滴加盐酸时没有泡产生.
①溶液甲中一定含有哪些溶质?__________(写化学式)
②请写出该实验过程中所发生反应的化学方程式______________.
(2)某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸(溶质质量分数为10%)49t,与足量废铁屑起反应,可生产硫酸亚铁的质量是_______.
【答案】Al(NO3)3、Zn(NO3) 2、Cu(NO3)2 ![]() 、
、![]() 7.6t
7.6t
【解析】
(1)金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,且金属活动性差距越大越易发生反应,向AgNO3和Al(NO3)3混合溶液中加入铜粉与锌粉,锌粉与AgNO3溶液反应生成硝酸锌和银,铜粉与硝酸银溶液反应生成硝酸铜和银,溶液甲呈蓝色,说明溶液中含有Cu(NO3)2,向固体乙上滴加盐酸时没有泡产生,说明固体中不含有锌。①溶液甲中一定含有没参加反应的Al(NO3)3、生成的Zn(NO3) 2、使溶液呈蓝色的Cu(NO3)2。②该实验过程中所发生反应的化学方程式有:![]() 、
、![]()
(2)解:稀硫酸中所含溶质的质量为49t×10%=4.9t,设生成硫酸亚铁的质量为x。
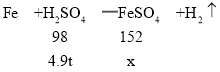
![]() ,解得x=7.6t,
,解得x=7.6t,
答:可生产硫酸亚铁的质量是7.6t。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业盐酸中通常含少量FeC13而呈黄色,小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50g,滴加溶质质量分数为20%的NaOH溶液,反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:
加入NaOH溶液的质量/g | 25 | 50 | 75 | 100 |
所得溶液的质量/g | 75 | 100 | 125 | m |
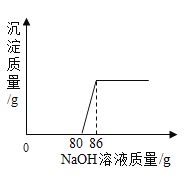
(1)开始没有产生沉淀的原因是_____。
(2)m=______(结果保留两位小数)。
(3)该工业盐酸中HCl的质量分数为_____。