题目内容
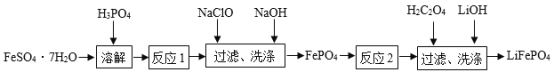
【题目】磷酸铁锂( LiFePO4)电池具有稳定性高、安全、对环境友好等优良性能,是目前最具有发展前景的锂电池正极材料。实验室可利用绿矾(FeSO4·7H2O)和磷酸(H3PO4)为原料制备LiFePO4,其流程如图所示。已知磷酸铁(FePO4)是一种难溶于水的白色固体。
试回答下列问题:
(1)NaClO中氯元素的化合价为________价。
(2)“溶解”步骤时H3PO4不宜过量太多的原因是__________。
(3)过滤操作中用到的玻璃仪器有:烧杯、玻璃棒和_____________。
(4)磷酸与氢氧化钠溶液反应化学方程式为:_______________;
(5)请你完成“反应2”总反应的化学方程式。2LiOH+6H2C2O4+2FePO4→2 LiFePO4+7CO2+5______+7HO(在横线中填写正确的化学式)。
【答案】+1 防止后续反应中消耗氢氧化钠,浪费原料 漏斗 H3PO4+3NaOH═Na3PO4+3H2O CO
【解析】
(1)NaClO中,钠元素的化合价是+1价,氧元素的化合价是-2价,根据在化合物中元素化合价的代数和为零,可以求出Cl元素的化合价是+1价;故填:+1;
(2)磷酸是一种酸,能与氢氧化钠发生中和反应,若“溶解”步骤时H3PO4过量太多就需要消耗较多的氢氧化钠,造成浪费;故填:防止后续反应中消耗氢氧化钠,浪费原料;
(3)过滤操作中用到的玻璃仪器有:烧杯、玻璃棒和漏斗;故填:漏斗;
(4)磷酸与氢氧化钠溶液反应生成磷酸钠和水,反应的化学方程式为:H3PO4+3NaOH═Na3PO4+3H2O;故填:H3PO4+3NaOH═Na3PO4+3H2O;
(5)由质量守恒定律可知,化学反应前后,原子的种类与数目保持不变。该化学方程式的反应物中有:2个锂原子、34个氧原子、14个氢原子、12个碳原子、2个铁原子和2个磷原子;反应物中有:2个锂原子、29个氧原子、14个氢原子、7个碳原子、2个铁原子和2个磷原子,所以5□中含有5个碳原子和5个氧原子,所以填写的化学式为CO;故填:CO。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案