题目内容
【题目】下列实验设计或结论合理的是 ( )
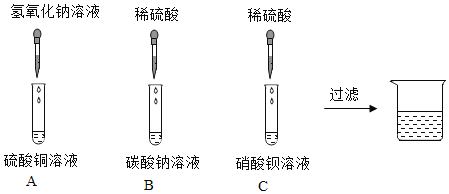
A.除去硫酸铜溶液中的硫酸,加足量的铜粉过滤
B.![]() 、Fe3+、
、Fe3+、![]() 、Na+四种离子可在pH=2的溶液中大量共存
、Na+四种离子可在pH=2的溶液中大量共存
C.分离碳酸钙和氯化钙的固体混合物,将混合物加入足量水搅拌,充分溶解,过滤
D.用一种试剂能把稀硫酸、NaOH溶液、BaCl2溶液一次性鉴别出来
【答案】D
【解析】
A、铜在金属活动性顺序表中位于氢的后面,即铜不能与酸反应生成氢气,所以除去硫酸铜溶液中的硫酸,加足量的铜粉不能达到除杂的目的,选项错误;
B、pH=2的溶液酸性较强,溶液中含有大量的氢离子,碳酸根离子与氢离子能够结合生成水和二氧化碳,所以CO32-、Fe3+、NO3-、Na+四种离子不可以在pH=2的溶液中大量共存,选项错误;
C、碳酸钙不溶于水,氯化钙易溶于水,分离碳酸钙和氯化钙的固体混合物时将混合物加入足量水搅拌,充分溶解、过滤,只能得到碳酸钙固体,不能得到氯化钙固体,还需要将滤液蒸发结晶才能得到氯化钙固体,选项错误;
D、碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳产生气泡,碳酸钠与氢氧化钠不反应,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,溶液中产生白色沉淀,使用碳酸钠溶液能把稀硫酸、NaOH溶液、BaCl2溶液一次性鉴别出来,选项正确,故选D。

练习册系列答案
相关题目