��Ŀ����
����Ŀ����������ʺ��Ʊ�������������������Ҫ��Ӧ�ã�
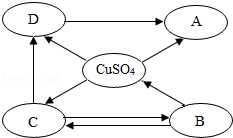
��1�����ᾧ����Ũ�������������ȷֽ⣬��ѧ����ʽΪH2C2O43H2O ![]() CO2��+CO��+4H2O��Ϊ֤������ֽ�IJ���֮һ��һ����̼��ij��ȤС���ͬѧ����ͼ1��ʾװ�ý���ʵ���о��� ��д��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ
CO2��+CO��+4H2O��Ϊ֤������ֽ�IJ���֮һ��һ����̼��ij��ȤС���ͬѧ����ͼ1��ʾװ�ý���ʵ���о��� ��д��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ
��Bװ�õ�������ʲô��
��֤�����ᾧ��ֽ�����д���CO��������ʲô��
�ܶ�Dװ�ü���ǰҪ��ͨ�������CO����Ŀ����ʲô��
��2����ʵ�����������ʯ��ʯ��Ӧ������ͼ2��ʾװ�ã����������ã����ж�����̼����ȡ������ʵ�飬��δ���ֳ���ʯ��ˮ����ǣ���Դ�����ͬѧ������̽���� 
���������롿
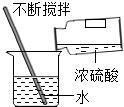
����һ������ʯ��ˮ���ʣ�
�������ʵ����ʹ�õ�Һ��ҩƷ�� �� ���ͨ��ʯ��ˮ�е�������˶�����̼�⣬�����Ȼ������壮
��ʵ��̽����
ʵ�� | ʵ�鲽�� | ʵ������ | ʵ����� |
ʵ��� | ��������CO2ͨ���ʵ�����õij���ʯ��ˮ�� | ����һ������ | |
ʵ��� | ����Ӧ����������ͨ�뵽 | �а�ɫ�������� | ��������� |
��3��ʵ����ȡ17g����������Һ��0.5g�������̻����ȡ��������ַ�Ӧ����ʣ����Һ������Ϊ17.1g����μӷ�Ӧ�Ĺ���������Һ�����ʵ����������Ƕ��٣�
���𰸡�
��1��2NaOH+CO2�TNa2CO3+H2O
��2��Ũ�����������Һ������ʯ��ˮ�����
��3���⣺�������������Ϊx��
��Ӧ������������Ϊ��17g+0.5g��17.1g=0.4g��
2H2O2 | O2�� |
68 | 32 |
x | 0.4g |
![]() =
= ![]() ��
��
x=0.85g��
��μӷ�Ӧ�Ĺ���������Һ�����ʵ����������ǣ� ![]() ��100%=5%��
��100%=5%��
�𣺲μӷ�Ӧ�Ĺ���������Һ�����ʵ�����������5%��
���������⣺��1����Aװ���У�������̼�ܺ��������Ʒ�Ӧ����̼���ƺ�ˮ��������Ӧ�Ļ�ѧ����ʽΪ��2NaOH+CO2�TNa2CO3+H2O�� ���2NaOH+CO2�TNa2CO3+H2O����Bװ�õ������Ǽ��������̼�Ƿ�����������Һ��ȫ���գ�
���Դ��ǣ����������̼�Ƿ�����������Һ��ȫ���գ���֤�����ᾧ��ֽ�����д���CO�������ǣ�D�еĺ���ɫ�����ɺ�ɫ���壬˵����������һ����̼�����˷�Ӧ����һ��˵�����ᾧ��ֽ�����д���һ����̼��
���Դ��ǣ�D�еĺ���ɫ�����ɺ�ɫ���壮�ܶ�Dװ�ü���ǰҪ��ͨ�������CO����Ŀ���ǣ��ų�װ���еĿ�������ֹ������ը��
���Դ��ǣ��ų�װ���еĿ�������ֹ������ը����2���������ʵ����ʹ�õ�Һ��ҩƷ��Ũ���ᣬ���ͨ��ʯ��ˮ�е�������˶�����̼�⣬�����Ȼ������壮
���Ũ���ᣮ��ʵ��̽����ʵ���������CO2ͨ���ʵ�����õij���ʯ��ˮ�У�����ʯ��ˮ����ǣ�˵������һ��������
ʵ�����Ӧ����������ͨ�뵽��������Һ�У�������ɫ������˵�������������ʵ��������±���ʾ��
ʵ�� | ʵ�鲽�� | ʵ������ | ʵ����� |
ʵ��� | ��������CO2ͨ���ʵ�����õij���ʯ��ˮ�� | ����ʯ��ˮ����� | ����һ������ |
ʵ��� | ����Ӧ����������ͨ�뵽��������Һ�� | �а�ɫ�������� | ��������� |
;��3���������������Ϊx��
��Ӧ������������Ϊ��17g+0.5g��17.1g=0.4g��
2H2O2 | O2�� |
68 | 32 |
X | 0.4g |
![]() =
= ![]() ��
��
x=0.85g��
��μӷ�Ӧ�Ĺ���������Һ�����ʵ����������ǣ� ![]() ��100%=5%��
��100%=5%��
�𣺲μӷ�Ӧ�Ĺ���������Һ�����ʵ�����������5%��
�����㾫�������ڱ��⿼�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ��㣬��Ҫ�˽�ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�Ȳ��ܵó���ȷ�𰸣�

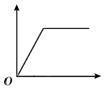
����Ŀ�����и�ѡ������ͼ��ʾ����������ǣ� ��
ѡ�� | �� �� �� | �� �� �� |
A | ��һ����ϡ�����м���п�۵����� | ��Һ����Ԫ�ص����� |
B | ��һ�������������ƺ�̼���ƻ����Һ�м���ϡ��������� | ������������� |
C | ��һ�����ij���ʯ��ˮ�м���̼������Һ������ | ���ɳ��������� |
D | ��һ���¶��£���һ�����IJ������������Һ�м�������ع�������� | ��Һ�����ʵ��������� |
A.A
B.B
C.C
D.D