题目内容
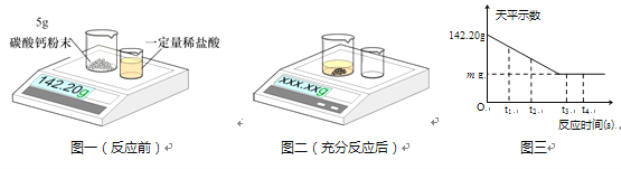
【题目】将12.5g石灰石与足量稀盐酸充分反应,产生的二氧化碳的质量与时间关系如图所示(杂质不和盐酸反应,也不溶解)。
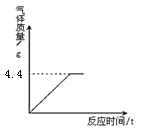
计算:①石灰石中所含碳酸钙的物质的量(根据化学方程式列式计算)。 (15)
②石灰石中碳酸钙的质量分数为 (16) 。
【答案】(1)二氧化碳的物质的量=4.4g÷44g/mol=0.1mol;
设碳酸钙物质的量为X
![]()
1 1
X 0.1mol
![]() X=0.1mol
X=0.1mol
(2)碳酸钙的质量=0.1g/mol×100g/mol=10g
碳酸钙的纯度=![]()
【解析】试题分析:
(1)n(CO2)=4.4÷44=0.1mol
设:石灰石中含碳酸钙Xmol
CaCO3+2HCl===CaCl2+CO2↑+H2O
1 1
Xmol 0.1mol
![]() =
=![]()
X=0.1mol
0.1mol的碳酸钙的质量=100g/mol ×0.1mol=10g
(2)石灰石中碳酸钙的质量分数=10g/12.5g ×100%=80%
答:石灰石中含碳酸钙0.1mol,石灰石中碳酸钙的质量分数为80%。

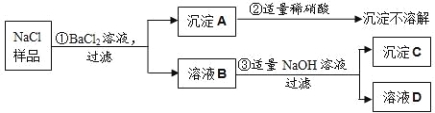
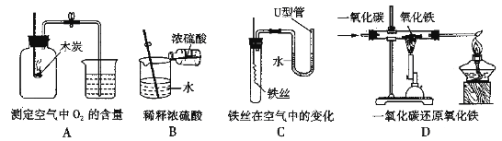
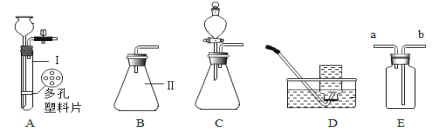
【题目】化学是一门以实验为基础的科学,请结合图示回答问题:
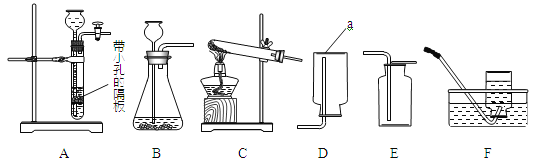
①写出仪器a的名称 (6) 。
②实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为 (7) ;
通常不用碳酸钙粉末与稀盐酸反应制取![]() 的原因是 (8) ;若要制取并收集一瓶
的原因是 (8) ;若要制取并收集一瓶![]() ,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
③实验室用双氧水和二氧化锰粉末制取氧气时;在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水,反应的化学方程式为 (11) 。哪些因素还影响着过氧化氢分解的速率?甲小组探究了溶质质量分数对过氧化氢分解的速率有影响,乙小组进行了更深入的探究:温度是否影响着过氧化氢分解的速率呢?
实 验 步 骤 | 现 象 | 结 论 |
取一支试管,加入5mL5%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中; | 缓慢有少量 气泡冒出 | (13) |
另取一支试管,加入 (12) , 然后把试管放入盛有热水的烧杯中。 | 迅速有大量 气泡冒出 |
④丙小组用装置C制取氧气,试管中固体的质量随加热时间变化的数据见下表。反应结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(I)组装装置C时,下列仪器用品的组装顺序是 (14) (填序号)。
a.试管 b.铁架台 c.酒精灯 d.木块
(II)共制得氧气的物质的量为 (15) mol。
(III)所得氯化钾溶液的溶质质量分数(根据化学方程式列式计算) (16) 。