题目内容
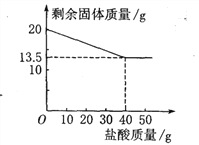
【题目】某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,各次稀盐酸用量和剩余固体质量记录如下:
实验次数 | 稀盐酸的用量/g | 剩余固体的质量/g |
1 | 10 | 18.375 |
2 | 10 | 16.750 |
3 | 10 | 15.125 |
4 | 10 | 13.500 |
5 | 10 | 13.500 |
(1)求铜锌合金中锌的质量分数为________.
(2)从图可知,当所用合金与稀盐酸的质量比为____________时,表明锌恰好完全溶解.
【答案】 32.5% 1:2
【解析】解:(1) 锌和盐酸反应,而铜和盐酸不反应,加入过量盐酸后,剩余固体为铜,铜的质量为13.5g;锌的质量=20g-13.5g=6.5g,合金中锌的质量分数为![]() ×100%=32.5%;
×100%=32.5%;
答:铜锌合金中锌的质量分数为32.5%;
(2) 由曲线图可知,加入40g盐酸后恰好完全反应,剩余13.5g铜,此时合金与稀盐酸的质量比=20:40=1:2,所以当所用合金与稀盐酸的质量比为1:2时,表明锌恰好完全溶解。

【题目】请你参与某学习小组的探究活动,并回答相关问题:
[发现问题]小丽发现盛水的铁锅在与水面接触的部位最易生锈;小茜发现自己的铜
制眼眶表面出现了绿色的铜锈;小玲发现苹果切开不久,果肉上会产生一层咖啡色物质,好像生了“锈”一般.
[提出问题]这三种物质“生锈”的原因是什么?
[收集证据] (1)回忆已有知识:铁生锈的条件是______________________________.
[查阅有关资料]“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);苹果“生锈”是果肉里的物质(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质.碱石灰能吸水.
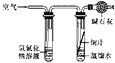
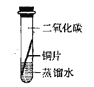
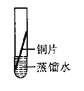
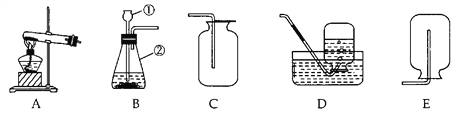
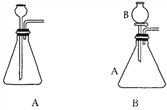
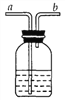
[实验探究]将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验 装置 |
|
|
|
|
实验验象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重 |
由实验可知,铜生锈是铜与水、__________、_________等物质共同作用的结果.
[得出结论]经过交流讨论,三位同学认为这些物质“生锈”除了可能与水有关外,还可能都与___________________(填物质名称)有关.
[反思与应用] 利用所得结论填空:
(1)写出一种防止铁或铜等金属制品生锈的具体方法_________________________.
(2)请你提出一条延长食品保质期的建议___________________________________.