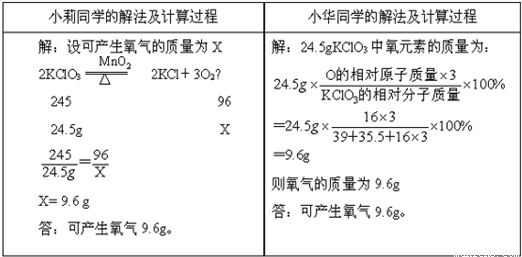
题目内容
氯酸钾受热分解的化学方程式为2KClO3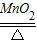 2KCl+3O2,对“24.5g氯酸钾受热完全分解产生多少克氧气一题”小莉和小华两位同学分别采用了两种不同的计算方法.
2KCl+3O2,对“24.5g氯酸钾受热完全分解产生多少克氧气一题”小莉和小华两位同学分别采用了两种不同的计算方法.| 小莉同学的解法及计算过程 | 小华同学的解法及计算过程 |
| 解:设可产生氧气的质量为X 2KClO3 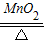 2KCl+3O2↑ 2KCl+3O2↑245 96 24.5g X 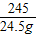 ═ ═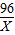 X═9.6g 答:可产生氧气9.6g. | 解:24.5g KClO3中氧元素的质量为: 24.5g×  ×100% ×100%═24.5g× 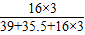 ×100% ×100%═9.6g 则氧气的质量为9.6g 答:可产生氧气9.6g. |
(1)你认为他们的解题思路和方法都正确吗?答:______.
(2)若要计算31.6g高锰酸钾受热完全分解产生氧气的质量,你认为也能用上述两种方法解答吗?
请你把能用的解法和计算过程写下来.
(3)你认为在什么情况下,小莉和小华同学的解法都能应用?
【答案】分析:(1)通过化学式计算出反应物中氧元素的质量,根据质量守恒定律中的元素质量守恒可以知道反应物中氧元素的质量就是生成氧气的质量;根据化学方程式由反应物的质量也可以计算出生成氧气的质量.(2)由于高锰酸钾中的氧元素没有全部变成氧气,因此本小题只能用化学方程式来计算;(3)对比上述两种情况就能得出本小题的答案.
解答:答:(1)都正确;
(2)不能.
能用的计算方法和过程如下:
解:设高锰酸钾反应生成氧气的质量为x.
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
31.6g x
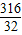 =
=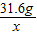 ,x=3.2g
,x=3.2g
答:生成氧气的质量为3.2g.
(3)反应物完全反应,且反应物中的氧元素全部变成氧气时,小莉和小华的解法才都能用.
点评:本题主要考查质量守恒定律、有关化学方程式和化学式的计算,难度稍大.
解答:答:(1)都正确;
(2)不能.
能用的计算方法和过程如下:
解:设高锰酸钾反应生成氧气的质量为x.
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 32
31.6g x
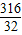 =
=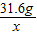 ,x=3.2g
,x=3.2g答:生成氧气的质量为3.2g.
(3)反应物完全反应,且反应物中的氧元素全部变成氧气时,小莉和小华的解法才都能用.
点评:本题主要考查质量守恒定律、有关化学方程式和化学式的计算,难度稍大.

练习册系列答案
相关题目
氯酸钾受热分解的化学方程式为2KClO3
2KCl+3O2,对“24.5g氯酸钾受热完全分解产生多少克氧气一题”小莉和小华两位同学分别采用了两种不同的计算方法.
试回答下问题:
(1)你认为他们的解题思路和方法都正确吗?答: .
(2)若要计算31.6g高锰酸钾受热完全分解产生氧气的质量,你认为也能用上述两种方法解答吗?
请你把能用的解法和计算过程写下来.
(3)你认为在什么情况下,小莉和小华同学的解法都能应用?
| ||
| △ |
| 小莉同学的解法及计算过程 | 小华同学的解法及计算过程 | ||||||||||||
| 解:设可产生氧气的质量为X 2KClO3
245 96 24.5g X
X═9.6g 答:可产生氧气9.6g. |
解:24.5g KClO3中氧元素的质量为: 24.5g×
═24.5g×
═9.6g 则氧气的质量为9.6g 答:可产生氧气9.6g. |
(1)你认为他们的解题思路和方法都正确吗?答:
(2)若要计算31.6g高锰酸钾受热完全分解产生氧气的质量,你认为也能用上述两种方法解答吗?
请你把能用的解法和计算过程写下来.
(3)你认为在什么情况下,小莉和小华同学的解法都能应用?
 25、白色的氯酸钾(KClO3)粉末受热,会缓慢放出氧气,同时得到白色的氯化钾.某探究小组想研究氧化铜能否对氯酸钾的受热分解起催化剂作用,设计如下装置及操作:
25、白色的氯酸钾(KClO3)粉末受热,会缓慢放出氧气,同时得到白色的氯化钾.某探究小组想研究氧化铜能否对氯酸钾的受热分解起催化剂作用,设计如下装置及操作: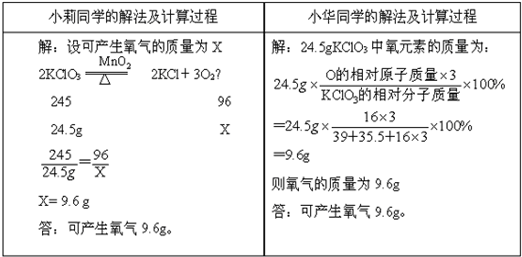

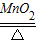 2KCl+3O2↑,对“24.5g氯酸钾受热完全分解产生多少克氧气一题”,小莉和小华两位同学分别采用了两种不同的计算方法.
2KCl+3O2↑,对“24.5g氯酸钾受热完全分解产生多少克氧气一题”,小莉和小华两位同学分别采用了两种不同的计算方法.