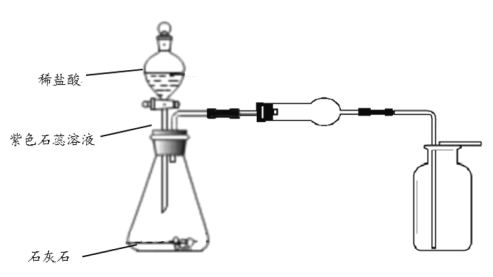
题目内容
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
(提出问题1)KI变质的条件是什么?
(查阅资料)
①KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
②碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
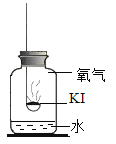
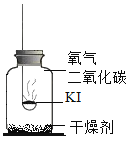
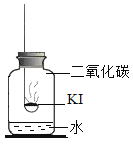
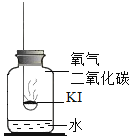
(进行实验)分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
(解释与结论)
(1)实验3的目的是_________________。
(2)对比实验__________,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_____________。
(提出问题2)CO2的作用是什么?
(进行实验)分别取10mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下,较长时间后,观察到试管1中溶液变为紫色。
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
(解释与结论)
(4)试管1实验的目的是____________。
(5)CO2在KI变质过程中的作用是__________________。
(反思与评价)
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_______________。
【答案】证明在有H2O和CO2无O2的条件下,碘化钾是否变质 2和4; H2O和O2同时存在; 和试管2、3做对比; 提供酸性环境,加快碘化钾变质 氮气和稀有气体化学性质稳定
【解析】
(1)根据图示分析可知,实验3的目的是:证明在有H2O和CO2无O2的条件下,碘化钾是否变质;
(2)实验2和4,除是否存在水这一个条件不同外,其他条件均相同,但实验现象不同,故对比实验2和4,可以得出KI变质一定与水有关;
(3)对比实验2和4,可以得出KI变质一定与水有关;同理实验1中存在的气体是氧气,实验3中存在的气体是二氧化碳,其他条件均相同,最终现象不同,对比实验1和3,可以得出KI变质一定与氧气有关。故从上述实验可推知,KI变质的条件是:H2O和O2同时存在;
(4)试管1实验的目的是:和试管2、3做对比,证明10mL同浓度的KI溶液,如果不通入二氧化碳或加入稀盐酸,几分钟后不会发生明显变化;
(5)二氧化碳和水反应生成碳酸,碳酸呈酸性,再结合实验现象,可以推知CO2在KI变质过程中的作用是:提供酸性环境,加快碘化钾变质;
(6)因为通常条件下,氮气和稀有气体的化学性质稳定,所以探究KI变质条件时,同学们排除了氮气和稀有气体的影响。

【题目】小峰同学查阅了KCl 和KNO3 在不同温度时的溶解度,并绘制出相应的溶解度曲线。
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | KCl | 34 | 37 | 42.6 | 45.5 | 51.1 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
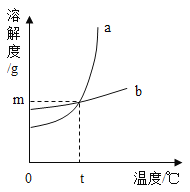
回答下列问题:
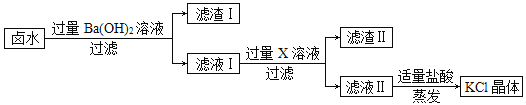
(1)图中表示KCl 溶解度曲线的是__________________(填 a 或 b),若硝酸钾中混有少量的氯化钾,提纯硝酸钾可以采取的方法是_____________。
(2)60℃时,将KCl 和KNO3 的饱和溶液同时降温到 20℃,则所得溶液中溶质的质量分数大小关系是KCl______________KNO3 (填“大于”、“等于“或“小于”)
(3) KCl 和KNO3 在 t℃时具有相同的溶解度(X),则 X 的取值范围是______________g。
(4)30℃时,将50gKNO3 固体放入 100g 水中充分溶解,所得溶液中溶质的质量分数为______________(计算结果精确到 0.1%)