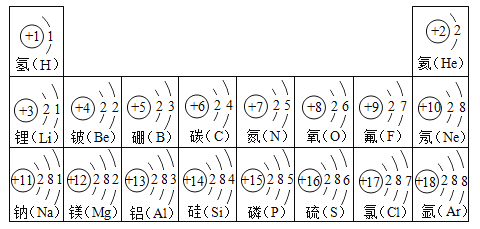
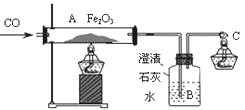
题目内容
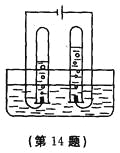
【题目】如图所示,将白磷和红磷分装于Y型试管的两个支管中,管口系牢小气球将两个支管同时伸入相同深度的热水中。请回答下列问题:

(1)燃烧的是____(填“a”、“b”或“c”)处,该处燃着的磷会很快熄灭,原因可能是____(填序号)。
A.温度降低 B.氧气耗尽
C.试管内产生了二氧化碳气体 D.着火点升高
(2)管口的小气球可以防止__________(填名称)进入空气,从而使该实验绿色化。
(3)热水的作用是____________________和_____________________。
【答案】aB五氧化二磷加热隔绝氧气
【解析】
(1)a处的白磷既与氧气接触,温度又达到了白磷的着火点,所以a处的白磷发生了燃烧;b处的红磷虽然与氧气接触,但是温度没有达到其着火点,所以不燃烧;c处的白磷虽然温度达到了其着火点,但是没有与氧气接触,也不会发生燃烧;a处燃着的白磷很快熄灭,是因为氧气耗尽了;(2)白磷燃烧生成的五氧化二磷有毒,为了防止造成空气污染,所以管口拴上一个气球;(3)烧杯中的热水的作用不仅提供热量,而且能隔绝空气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】属于分解反应的是( )
A. H2CO3=CO2↑+H2O B. CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
C. CO2+H2O=H2CO3 D. 2Mg + CO2![]() 2MgO + C
2MgO + C
【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
(1)根据如表提供的信息,填写有关含碳物质的对应性质.
物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 |
对应性质 | ①___________ | ②___________ | ③___________ |
(2)请要求填写出含碳元素的物质的化学式.
A﹣可以燃烧的氧化物___________,B禁止喝后开车的饮品___________.
(3)木炭可用于冶炼金属,请写出木炭与氧化铜反应的方程式:___________,该反应体现木炭的___________性.
(4)“碳海绵”是已知最轻的固体材料(如图所示),由碳元素组成,具有多孔结构,弹性好.它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后可恢复原状.下列关于碳海绵的说法正确的是___________(填字母序号).

A.具有吸附性 B.可重复使用 C.可处理海上石油泄漏
(5)目前我市很多居民家中都以天然气为燃料,天然气的主要成分是___________(填化学式),从下表数据分析,等质量的天然气和煤完全燃烧,___________燃烧产生二氧化碳的质量小,放出的热量更多.
物质 | 1g物质完全燃烧 | |
产生二氧化碳的质量/g | 放出的热量/kJ | |
天然气 | 2.75 | 56 |
煤 | 3.67 | 32 |