题目内容
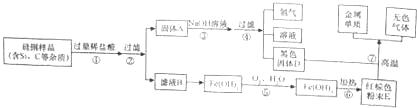
【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略)。
查阅资料发现:
常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO3+2H2↑)。
根据以上信息,回答下列问题:
(1)固体A的成分为 ,E的化学式为 。
(2)滤液B中的金属阳离子为 。
(3)在过滤操作时,若发现滤液浑浊,应 。
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 。
【答案】
(1)碳、硅 Fe2O3;
(2)Fe2+
(3)查找原因,处理后重新过滤
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
试题分析:
(1)硅钢中的铁和盐酸反应会生成氯化亚铁和氢气,所以滤液B是氯化亚铁,固体A中含有碳、硅,硅和氢氧化钠溶液反应会生成硅酸钠和氢气,所以黑色固体D是碳,氢氧化铁加热生成氧化铁和水,所以E是氧化铁,氧化铁和碳在高温的条件下生成铁和二氧化碳,经过验证,推导正确,所以A是碳、硅,E的化学式为:Fe2O3;
(2)硅钢中主要含有Fe、C、Si,只有Fe能与稀盐酸反应生成氯化亚铁,所以剩余的固体A的成分中含有C、Si,滤液B中的金属阳离子为Fe2+;
(3)在过滤操作时,若发现滤液浑浊,应查找原因,处理后重新过滤;
(4)步骤⑤中发生的是化合反应中,反应物是Fe(OH)2与氧气和水,生成物是氢氧化铁,化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
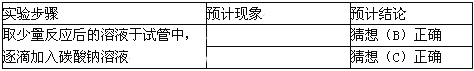
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证:
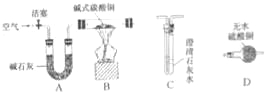
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。