题目内容
【题目】某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
(1)写出该中和反应的化学方程式_______________________。
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】 (A)溶质可能是CaCl2与Ca(OH)2 (B)可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是_____________。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
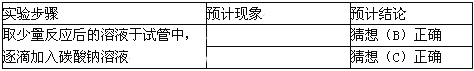
【交流反思】 为确定猜想(C)正确,下列几种实验方案不合理的是______(填字母)。
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH <7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀
【答案】(1)Ca(OH)2 + 2HCl = CaCl2 + 2H2O (2)①Ca(OH)2溶液显碱性能使酚酞变红
②
【交流反思】D
【解析】
试题分析:(1)氢氧化钙溶液和盐酸反应的化学方程式是:Ca(OH)2 + 2HCl = CaCl2 + 2H2O ①Ca(OH)2溶液显碱性能使酚酞变红 ②有关的反应:Na2CO3+ CaCl2= CaCO3↓+2 NaCl, Na2CO3+2HCl==2NaCl+CO2↑+H2O 故根据结论可以推测反应现象
【交流反思】猜想(C):溶质可能是CaCl2与HCl A、若猜想(C)正确,溶液显酸性,滴加紫色石蕊试液变红色,正确;B、盐酸能与锌反应产生氢气,正确;C、溶液显酸性,其pH<7,正确;D、因为溶液中含有氯化钙,无论是否含有盐酸,加入硝酸银溶液,都会生成白色沉淀,
CaCl2 +2AgNO3=2AgCl↓+ Ca(NO3)2,错误,故选D