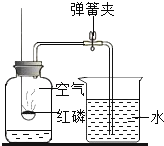
题目内容
【题目】元素周期表是化学学习的重要工具,依据下表回答问题:
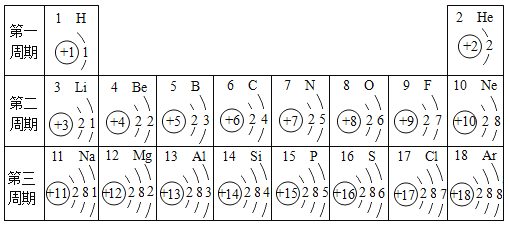
(1)表中17号元素的原子在化学反应中易__________(填“得到”或“失去”)电子,形成相对稳定结构,其离子符号为_______________。
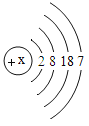
(2)某原子结构示意图如图所示:则X= ______ ,它位于元素周期表中的第_______周期,该元素的化学性质与上表中的_________元素的化学性质相似(填元素符号)。
(3)同一周期中的元素,其原子结构呈现的规律有______________(任写一点)。
【答案】得到 Cl- 35 四 F、Cl 最外层电子数依次递增/核电荷数依次递增/电子层数相同(合理即可)
【解析】
(1)17号元素是氯元素,其最外层有7个电子,在化学反应中易得到1个电子而形成带一个单位负电荷的氯离子;故填:得到;Cl-;
(2)元素周期表中周期数等于原子核外电子层数,由元素的原子结构示意图,质子数等于核外电子数,所以X=2+8+18+7=35,由原子结构示意图,其原子核外有4个电子层,该元素位于元素周期表第四周期,最外层电子数为7,容易得到1个电子,化学性质与F、Cl相似;故填:35;四;F、Cl。
(3)同一周期中的元素,其原子结构呈现的规律:最外层电子数依次递增/核电荷数依次递增/电子层数相同。
故填:最外层电子数依次递增/核电荷数依次递增/电子层数相同(合理即可)。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】某化学学习小组为了测定某石灰石中碳酸钙的质量分数,取一定量的石灰石样品于烧杯中,加入适量的稀盐酸,恰好完全反应。有关数据记录如下表所示: (样品中其他成分 均不与稀盐酸反应且不溶于水)
反应前 | 反应后 | ||
实验数据 | 石灰石样品的质量 | 加入稀盐酸的质量 | 烧杯中剩余物质的总质量 |
32g | 60g | 83.2g | |
请计算: (1) 完全反应时生成气体的质量为_____ g.
(2) 该石灰石样品中碳酸钙的质量分数? _____(计算题中也会要用到化学力程式啊。看来,化学方程式非掌握不可。此刻,希望你能“破涕为笑”,愉快地结束本堂考试,祝你好运! )