题目内容
(2012?海淀区一模)工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸.焙烧后的矿渣用于炼铁.其转化过程如下(部分条件和产物已略去).

请回答下列问题:
(1)如图出现的含硫元素的物质中,属于氧化物的有
(2)FeS2中的铁元素是+2价,硫元素的化合价为
(3)写出②处炼铁的化学方程式
(4)在煤炭燃烧过程中也会产生SO2.工业上将煤燃烧产生的烟气通入吸收塔,用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水.请写出该反应的化学方程式

请回答下列问题:
(1)如图出现的含硫元素的物质中,属于氧化物的有
SO2、SO3
SO2、SO3
(填化学式).(2)FeS2中的铁元素是+2价,硫元素的化合价为
-1
-1
.(3)写出②处炼铁的化学方程式
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.若用2000t含杂质30%的矿渣炼铁,理论上可得到含铁98%的生铁质量为
| ||
1000
1000
t.(4)在煤炭燃烧过程中也会产生SO2.工业上将煤燃烧产生的烟气通入吸收塔,用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水.请写出该反应的化学方程式
2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O
2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O
.分析:(1)根据氧化物的概念:氧化物中只有两种元素且是含有氧元素的化合物,进行分析解答.
(2)根据在化合物中正负化合价代数和为零,结合FeS2的化学式进行解答本题.
(3)根据炼铁的反应原理可知,结合化学方程式的书写方法、步骤,写出炼铁反应的化学方程式即可.由矿渣的质量、杂质的质量分数、生铁中铁的质量分数,根据炼铁的化学方程式可以列式计算出炼出生铁的质量.
(4)根据题意,产生的SO2用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水,写出反应的化学方程式即可.
(2)根据在化合物中正负化合价代数和为零,结合FeS2的化学式进行解答本题.
(3)根据炼铁的反应原理可知,结合化学方程式的书写方法、步骤,写出炼铁反应的化学方程式即可.由矿渣的质量、杂质的质量分数、生铁中铁的质量分数,根据炼铁的化学方程式可以列式计算出炼出生铁的质量.
(4)根据题意,产生的SO2用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水,写出反应的化学方程式即可.
解答:解:(1)图中出现的含硫元素的物质中,SO2、SO3是由两种元素组成的且有一种是氧元素的化合物,均属于氧化物;H2SO4是由氢、硫、氧三种元素组成的化合物,不属于氧化物.
(2)铁氧元素显+2,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可知FeS2中硫元素的化合价:(+2)+2x=0,则x=-1.
(3)工业上炼铁是用还原剂一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3
2Fe+3CO2;
设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO
3CO2+2Fe
160 112
2000t×(1-30%) 98%x
=
x=1000t
(4)根据题意,SO2、石灰水、氧气反应生成硫酸钙和水,反应的化学方程式为2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O.
故答案为:(1)SO2、SO3;(2)-1;(3)3CO+Fe2O3
2Fe+3CO2;1000;(4)2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O.
(2)铁氧元素显+2,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可知FeS2中硫元素的化合价:(+2)+2x=0,则x=-1.
(3)工业上炼铁是用还原剂一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3
| ||
设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO
| ||
160 112
2000t×(1-30%) 98%x
| 160 |
| 112 |
| 2000t×(1-30%) |
| 98%x |
(4)根据题意,SO2、石灰水、氧气反应生成硫酸钙和水,反应的化学方程式为2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O.
故答案为:(1)SO2、SO3;(2)-1;(3)3CO+Fe2O3
| ||
点评:本题难度不大,掌握氧化物的特征、利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、含杂质物质的化学方程式的计算等是正确解答本题的关键.

练习册系列答案
相关题目
 (2012?海淀区一模)NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题.
(2012?海淀区一模)NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题. 
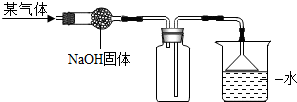 (2012?海淀区一模)如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )
(2012?海淀区一模)如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( ) 